题目内容
【题目】乙烯是用途最广泛的基本有机原料,可用于生产塑料、合成橡胶等产品。工业上可用乙烷、二氧化碳、甲醇、乙醇等为原料制乙烯。请回答下列相关问题。
(1)已知H2、C2H4、C2H6的燃烧热依次是286kJ/mol、1411kJ/mol、1560kJ/mol,乙烷热裂解制乙烯的热化学方程式是![]() ,则
,则![]() =_______________。
=_______________。
(2)工业上用乙烷热裂解制乙烯时,通常会在保持起始压强不变的情况下用水蒸气对乙烷稀释以提高平衡转化率,其原理是______________________________________________。
向温度为1015K、体积为5L的刚性容器中充入0.03mol水蒸气和0.06mol乙烷,起始压强为0.15MPa,30s后体系达到平衡,乙烷的平衡转化率为60%,则建立平衡的过程中平均反应速率v(H2)=______________mol/(L·s),![]() 的平衡常数KP=_______________MPa。
的平衡常数KP=_______________MPa。
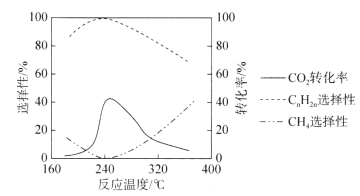
(3)二氧化碳的资源化是目前的热门研究领域,在催化剂的作用下二氧化碳可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率、CH4选择性、CnH2n选择性的影响如下图所示,从生产低级烯烃的角度考虑,最合适的反应温度是___________。资料显示原料气中![]() 时,随着
时,随着![]() 的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
【答案】![]() 用水蒸气对原料气进行稀释相当于减压,热裂解反应平衡正向移动,平衡转化率增大(答案合理即可)
用水蒸气对原料气进行稀释相当于减压,热裂解反应平衡正向移动,平衡转化率增大(答案合理即可) ![]() 0.09 240℃ 低级烯烃与氢气发生加成反应生成烷烃
0.09 240℃ 低级烯烃与氢气发生加成反应生成烷烃
【解析】
(1)依据盖斯定律计算可得;
(2)热裂解反应是气体体积增大的反应,用水蒸气对原料气进行稀释相当于减压;依据速率公式和分压平衡常数计算可得;
(3)由图可知,240℃时,二氧化碳转化率和低级烯烃选择性最高,甲烷选择性最低;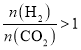 时,随着
时,随着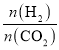 的增大,低级烯烃的选择性逐渐降低,说明生成的烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其它反应,可能是烯烃与氢气发生加成反应生成了烷烃。
的增大,低级烯烃的选择性逐渐降低,说明生成的烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其它反应,可能是烯烃与氢气发生加成反应生成了烷烃。
(1)根据![]() 的燃烧热可得如下热化学方程式:
的燃烧热可得如下热化学方程式:
①![]()
②![]()
③![]()
根据盖斯定律,③—①—②可得乙烷热裂解制乙烯的热化学方程式是![]() ,则
,则![]() ,故答案为:
,故答案为:![]() ;
;
(2)热裂解反应是气体体积增大的反应,用水蒸气对原料气进行稀释相当于减压,热裂解反应平衡正向移动,因此平衡转化率增大;由化学计量数之比等于化学反应速率之比可得
![]() ;容器中起始总物质的量为
;容器中起始总物质的量为![]() ,压强为
,压强为![]() ,根据题中数据可知,平衡时乙烷、乙烯、氢气的物质的量依次为0.06mol—0.06mol×60%=0.024mol,0.06mol×60%=0.036mol,0.06mol×60%=0.036mol,此时容器中总物质的量为(0.024mol+0.036mol+0.036mol+0.03mol)=0.126mol,由
,根据题中数据可知,平衡时乙烷、乙烯、氢气的物质的量依次为0.06mol—0.06mol×60%=0.024mol,0.06mol×60%=0.036mol,0.06mol×60%=0.036mol,此时容器中总物质的量为(0.024mol+0.036mol+0.036mol+0.03mol)=0.126mol,由![]() 可得平衡时压强为
可得平衡时压强为![]() ,则乙烷、乙烯、氢气的平衡分压依次为
,则乙烷、乙烯、氢气的平衡分压依次为![]() ,
,![]() ,故答案为:0.09;
,故答案为:0.09;
(3)由图可知,240℃时,二氧化碳转化率和低级烯烃选择性最高,甲烷选择性最低,因此应选择240℃;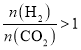 时,随着
时,随着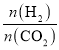 的增大,低级烯烃的选择性逐渐降低,说明生成的烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其它反应,可能是烯烃与氢气发生加成反应生成了烷烃,故答案为:240℃;低级烯烃与氢气发生加成反应生成烷烃。
的增大,低级烯烃的选择性逐渐降低,说明生成的烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其它反应,可能是烯烃与氢气发生加成反应生成了烷烃,故答案为:240℃;低级烯烃与氢气发生加成反应生成烷烃。