题目内容
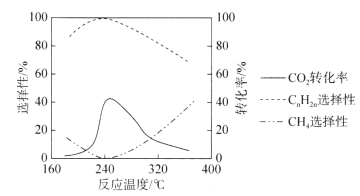
【题目】如图是:600℃ 时,在2L密闭容器里A、B、C三种气体在密闭容器中反应时浓度的变化,其中A为有色气体,B、C是无色气体。请从图中分析并填空:
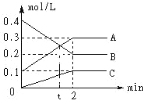
(1)该反应的化学反应方程式为_____
(2)反应达到平衡状态时,反应物的转化率为_____
(3)当反应进行到第_____min,该反应达到平衡。
(4)反应从开始至2分钟末,B的物质的量_____,用B的浓度变化表示的平均反应速率为v(B)=_
(5)下列描述能表示反应达平衡状态的是_____(填选项)。
a.容器中A与B的物质的量相等
b.容器内气体的颜色不再改变
c.各物质的浓度保持不变
【答案】2B(g)![]() 2A(g)+C(g) 50% 2 由0.8mol减少为0.4mol 0.1mol·L-1·min-1 bc
2A(g)+C(g) 50% 2 由0.8mol减少为0.4mol 0.1mol·L-1·min-1 bc
【解析】
分析题给c-t图,可以看出A、C浓度随着时间的进行逐渐增大,2min后保持不变,B的浓度随着时间的进行逐渐减小,2min后保持不变,由此可知,B为反应物,A、C为生成物。且在2min时达到平衡状态。结合其浓度的变化值,可以推导出该反应的反应方程式并进行相关计算。
(1)由图知:B为反应物,A、C为生成物。A、B、C的浓度变化值分别为:![]() ,
,![]() ,
,![]() 。根据同一反应中各物质表示的反应速率之比等于反应方程式中相应物质的化学计量数之比,可知A、B、C的化学计量数之比为:
。根据同一反应中各物质表示的反应速率之比等于反应方程式中相应物质的化学计量数之比,可知A、B、C的化学计量数之比为:![]() ,故反应方程式为:2B(g)
,故反应方程式为:2B(g)![]() 2A(g)+C(g);答案为:2B(g)
2A(g)+C(g);答案为:2B(g)![]() 2A(g)+C(g);
2A(g)+C(g);
(2)由图可知,平衡时B物质的浓度为0.2mol/L,反应物B的转化浓度=![]() ,则B的转化率=
,则B的转化率=![]() ,答案为:50%;
,答案为:50%;
(3)由图可知,反应在2min时各物质的浓度保持不变,可知在2min时该反应达平衡状态,答案为:2;
(4)据图可得:开始时,B的物质的量为![]() ,2min末,B的物质的量为
,2min末,B的物质的量为![]() ,反应从开始至2分钟末,B的物质的量由0.8mol减少为0.4mol;
,反应从开始至2分钟末,B的物质的量由0.8mol减少为0.4mol;![]() ,根据反应速率定义,用B的浓度变化表示的反应速率v(B)=
,根据反应速率定义,用B的浓度变化表示的反应速率v(B)=![]() ;故答案为:由0.8mol减少为0.4mol;0.1mol·L-1·min-1;
;故答案为:由0.8mol减少为0.4mol;0.1mol·L-1·min-1;
(5)反应达平衡状态时正逆反应速率相等,反应物和生成物的质量或浓度保持不变,据此判断:
a.由图可以看出,在t min时,A、B物质的量浓度相等,物质的量也相等。但此时反应不是平衡状态,故A、B物质的量相等不能表示反应达平衡状态,a项错误;
b.A为有色气体,B、C是无色气体。含有有色物质的体系颜色不再发生变化,可以表示反应达平衡状态,b项正确;
c.各物质的浓度保持不变可以表示反应达平衡状态,c项正确;
答案选bc。故答案为:bc。

 高中必刷题系列答案
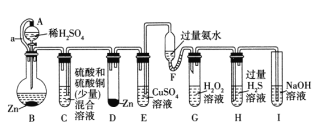
高中必刷题系列答案【题目】下列实验操作中,根据实验现象得出的结论正确的是
选项 | 操作 | 现象 | 结论 |
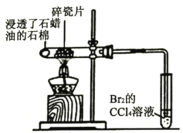
A |
| Br2的CCl4溶液褪色 | 石蜡油分解产生乙烯气体 |
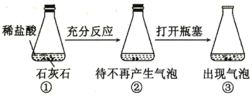
B |
| ③中出现气泡 | 可以用平衡移动原理解释 |
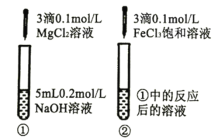
C |
| ①中出现白色沉淀 ②中出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
D |
| 淀粉碘化钾溶液变蓝 | b为直流电源负极 |
A.AB.BC.CD.D