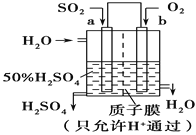
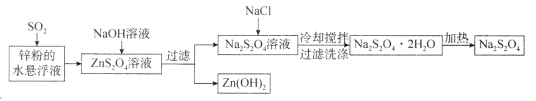
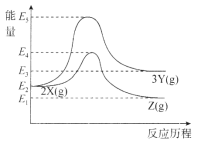
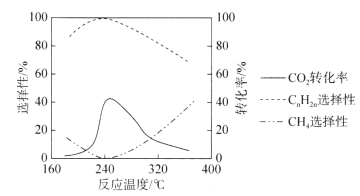
题目内容
【题目】常温下向10mL0.1mol/L的NaCN溶液中滴加等浓度的盐酸(忽略体积和温度变化),δ(HCN)和![]() 随溶液pH变化的图像如图所示,下列说法错误的是
随溶液pH变化的图像如图所示,下列说法错误的是
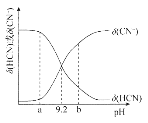
A.常温下HCN的电离常数为l0-9.2
B.pH为9.2时,加入盐酸的体积大于5mL
C.pH为a时溶液中c(Cl-)大于pH为b时溶液中c(Cl-)
D.滴加过程中可能出现:c(Na+)>c(CN-)>c(OH-)>c(Cl-)>c(H+)
【答案】B
【解析】
A.pH为9.2时,![]() ,即
,即![]() ,此时
,此时![]() 的电离常数
的电离常数![]() ,故A正确;
,故A正确;
B.加入![]() 盐酸时,所得溶液中
盐酸时,所得溶液中![]() 和
和![]() 物质的量浓度相等,
物质的量浓度相等,![]() 的电离常数
的电离常数![]() ,
,![]() 的水解常数
的水解常数![]() ,等浓度时
,等浓度时![]() 的水解程度大于
的水解程度大于![]() 的电离程度,混合溶液中
的电离程度,混合溶液中![]() ,要想使二者相等,加入的盐酸体积应小于
,要想使二者相等,加入的盐酸体积应小于![]() ,故B错误;
,故B错误;
C.从图像中![]() 和
和![]() 的变化趋势可知,从左到右溶液的pH逐渐增大,因此pH为a时加入盐酸的量大于pH为b时加入盐酸的量,因此pH为a时溶液中
的变化趋势可知,从左到右溶液的pH逐渐增大,因此pH为a时加入盐酸的量大于pH为b时加入盐酸的量,因此pH为a时溶液中![]() 大于pH为b时溶液中
大于pH为b时溶液中![]() ,故C正确;
,故C正确;
D.滴加盐酸的量很少时,溶液中会出现![]() 的情况,故D正确;
的情况,故D正确;
故选B。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目