题目内容
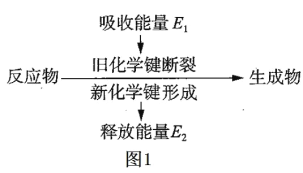
【题目】(1)如图 1 是化学反应中物质变化和能量变化的示意图。在锌与稀盐酸的反应中,E1 _____ E2 (填“>”或“<”或“=”)
(2)工业上利用 CO 和 H2 在催化剂作用下合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则 CO(g)+2H2(g) ![]() CH3OH(g) △H=_____kJmol-1
CH3OH(g) △H=_____kJmol-1
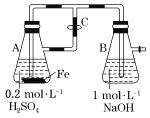
(3)化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
a.用量筒量取 50 mL 0.50 mol·L-1 盐酸倒入如图装置的小烧杯中,测出盐酸温度。 b.用另一量筒量取 50 mL 0.55 mol·L-1 NaOH 溶液,并用另一温度计测出其温度。 c.将 NaOH 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
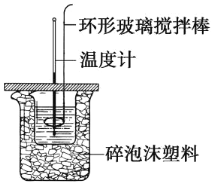
①实验中,倒入 NaOH 溶液的正确操作是_____。
A.一次性快速倒入 B.分 3 次倒入 C.边搅拌边慢慢倒入
②若将各含 1mol 溶质的 NaOH 稀溶液、Ca(OH)2 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为 Q1、Q2、Q3,则 Q1、Q2、Q3 的关系为_____。
③假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。某学生实验后,处理数据,得到实验变化的温度为 3.20℃。该实验测得中和热ΔH =_____(结果保留一位小数)。
【答案】< 99 A Q2> Q1>Q3 -53.5kJ/mol
【解析】
(1)活泼金属与酸的反应属于放热反应,即反应物的总键能小于生成物的总键能,反应物断键吸收的能量E1小于生成物成键释放的能量E2;
故答案为:<;
(2)根据反应CO(g)+2H2(g) ![]() CH3OH(g),反应热=反应物总键能生成物总键能,故△H=1076 kJ/mol +2×436 kJ/mol (3×413+343+465) kJ/mol =99 kJ/mol;
CH3OH(g),反应热=反应物总键能生成物总键能,故△H=1076 kJ/mol +2×436 kJ/mol (3×413+343+465) kJ/mol =99 kJ/mol;
答案为:99;
(3)①倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故答案为:A;
②中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,含 1mol 氢氧化钠的稀氢氧化钠溶液和足量稀盐酸完全反应生成1mol水,放热57.3kJ;含 1mol 氢氧化钙的稀氢氧化钙溶液和足量稀盐酸完全反应生成2mol水,放热57.3 kJ×2=114.6kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热,含 1mol一水合氨的稀氨水和足量的稀盐酸完全反应生成1mol水,放热小于57.3kJ,所以Q2> Q1>Q3;
故答案为:Q2> Q1>Q3;
③根据中和反应:H+ +OH- =H2O,50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液反应生成0.025mol的水;50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.20℃=1.3776kJ,即生成0.025mol的水放出热量为:1.3776kJ,所以生成1mol的水放出热量为1.3776kJ×![]() =53.5kJ,即该实验测得的中和热△H=-53.5kJ/mol;
=53.5kJ,即该实验测得的中和热△H=-53.5kJ/mol;
故答案为:-53.5kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。