题目内容
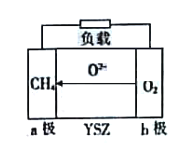
【题目】科研人员研制出透氧膜,它允许e-和O2-同时通过,可实现水连续分解制备氢气,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示,下列说法正确的是
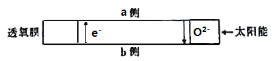
A.CO在a侧上反应
B.b侧的反应式:H2O+2e- = H2↑+ O2-
C.该透氧膜可实现太阳能向氢能的转化
D.当有2mol电子通过透氧膜时,就会消耗22.4L CO
【答案】C
【解析】
根据题意判断该装置是原电池,该装置连续分解水制H2的化学方程式为CO+H2O=CO2+H2,由原电池的“电子不下水,离子不上岸”规律可知:该装置的透氧膜是内电路,根据O2-由a→b判断a侧电极为正极、b侧电极为负极,即负极原料CO在b侧;正极原料H2O得电子生成H2和O2-,故a侧电极反应式为H2O+2e-=H2↑+O2-,据此分析解答。
A.根据分析,负极原料CO在b侧,故A错误;
B.结合分析,b侧电极为负极,发生氧化反应,失去电子,a侧电极的反应式:H2O+2e- = H2↑+ O2-,故B错误;
C.根据装置图所示,利用太阳能将水在透氧膜上转化氢气,实现太阳能向氢能的转化,故C正确;
D.根据a侧电极反应式为H2O+2e-=H2↑+O2-,当有2mol电子通过透氧膜时,会消耗1mol水,结合电池总反应:CO+H2O=CO2+H2,同时会消耗1mol CO,标况下的体积为22.4L,但题中为指明状态条件,故D错误;
答案选C。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】化合物W是合成一种抗心律失常药物的中间物质,一种合成该物质的路线如下:

(1)ClCH2CH2C1的名称是____________。
(2)E中不含氧的官能团的名称为____________。
(3)C的分子式为__________,B→C的反应类型是____________。
(4)筛选C→D的最优反应条件(各组别条件得到的D的产率不同)如下表所示:
组别 | 加料温度 | 反应溶剂 | AlCl3的用量(摩尔当量) |
① | -30~0℃ |
| 1 eq |
② | -20~-10℃ |
| 1 eq |
③ | -20~-10℃ | ClCH2CH2Cl | 1 eq |
上述实验筛选了________和________对物质D产率的影响。此外还可以进一步探究___________对物质D产率的影响。
(5)M为A的同分异构体,写出满足下列条件的M的结构简式:__________________。
①除苯环外不含其他环;②有四种不同化学环境的氢,个数比为1:1:2:2;③1 mol M只能与1mol NaOH反应。
(6)结合上述合成路线,写出以![]() 、CH3I和SOCl2为基本原料合成
、CH3I和SOCl2为基本原料合成![]() 的路线图。(其他所需无机试剂及溶剂任选)
的路线图。(其他所需无机试剂及溶剂任选)
已知,RCOOH![]() RCOCl。
RCOCl。
____________________________________________________________________________________________。