题目内容
【题目】下列说法不正确的是( )
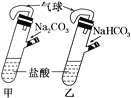
A.分别在甲乙两支侧管中装入1.06gNa2CO3和0.84gNaHCO3,试管中各有10mL相同浓度的盐酸(如图)同时将两个侧管中的物质全部倒入各自的试管中,乙装置的气球膨胀速率大
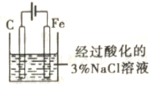
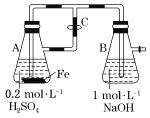
B.用如图装置可以制备沉淀Fe(OH)2
C.取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色。结论:该Fe(NO3)2试样已经变质
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤
【答案】C
【解析】
A、甲中碳酸钠和盐酸反应分步进行,先生成碳酸氢钠,后碳酸氢钠和盐酸反应生成二氧化碳,乙中碳酸氢钠直接和盐酸反应生成二氧化碳,所以乙装置的气球膨胀速率大,故A正确;
B、开始反应时,A中生成的氢气由C进入B,排出B中的空气,可以防止氢氧化亚铁被氧化,一段时间后,关闭止水夹C,A中的硫酸亚铁进入B,与氢氧化钠反应生成Fe(OH)2,故B正确;
C、Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,发生反应3Fe2++4H++NO3-=3Fe3++2H2O+NO![]() ,生成Fe3+,干扰变质的检验,故C错误;
,生成Fe3+,干扰变质的检验,故C错误;
D、Al(OH)3中混有少量Mg(OH)2,加入足量烧碱溶液充分反应,Al(OH)3与氢氧化钠反应生成偏铝酸钠,过滤,向滤液中通入过量CO2生成氢氧化铝沉淀,故D正确。
答案选C。

【题目】为达到实验目的,下列选用的装置、实验操作均正确的是
实验目的 | 实验步骤和装置 | |
A | 比较H2O2和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
B | 配制100 mL 1.0 mol·L-1NaOH溶液 | 向100mL容量瓶中加入4.0 g NaOH固体,加水到刻度线 |
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 探究温度对反应速率的影响 | 将两片大小相同的淀粉碘化钾试纸分别放置于两支规格相同的试管中,向试纸上滴加2.0 mol·L-1的H2SO4溶液2~3滴,密封试管,分别在室温和40℃水浴中反应,观察并记录变色时间 |
A.AB.BC.CD.D