题目内容
16.欲配制下列各组离子的溶液,能够实现的是( )| A. | Cu2+、Br-、HCO3-、AlO2- | B. | Fe3+、K+、SCN-、SO42- | ||
| C. | Fe2+、NO3-、HSO3-、Ag+ | D. | Na+、AlO2-、K+、C6H5O- |
分析 配制的溶液中的各离子之间不反应,能够大量共存,
A.铜离子与碳酸氢根离子、偏铝酸根离子发生双水解反应,碳酸氢根离子的酸性大于氢氧化铝,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀和碳酸根离子;
B.铁离子与硫氰根离子反应生成硫氰化铁;
C.亚铁离子、银离子能够与亚硫酸氢根离子反应,亚硫酸根离子能够电离出氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子和亚硫酸氢根离子;
D.四种离子之间不发生反应,能够共存.
解答 解:溶液中存在的各离子之间应该不发生反应,可大量共存,
A.Cu2+与HCO3-、AlO2-发生双水解反应,碳酸氢根离子的酸性大于氢氧化铝,HCO3-、AlO2-反应生成氢氧化铝沉淀和碳酸根离子,在溶液中不能大量共存,故A错误;
B.Fe3+、SCN-之间反应生成氯化氢硫氰化铁,在溶液中不能大量共存,故B错误;
C.Fe2+、Ag+能够与HSO3-离子反应,HSO3-能够电离出氢离子,NO3-在酸性条件下能够氧化Fe2+、HSO3-,在溶液中不能大量共存,故C错误;
D.Na+、AlO2-、K+、C6H5O-之间不发生反应,能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识的能力.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
6.下列事实可以说明元素甲的金属性一定比元素乙的金属性强的是( )
①甲能与乙的盐溶液发生化学反应
②常温下,甲单质能与浓硝酸剧烈反应而乙单质却不能
③甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙的原子半径
④甲、乙两短周期主族元素原子的电子层数相同,且甲的原子半径小于乙的原子半径.
①甲能与乙的盐溶液发生化学反应
②常温下,甲单质能与浓硝酸剧烈反应而乙单质却不能
③甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙的原子半径
④甲、乙两短周期主族元素原子的电子层数相同,且甲的原子半径小于乙的原子半径.
| A. | 全部都可以 | B. | 全部都不可以 | C. | ②③④ | D. | 仅①可以 |
3.世界著名的科技史专家,英国剑桥大学的李约瑟博士考证说:“中国至少在距今3 000年以前,就已经使用玻璃了.”下列有关玻璃的说法不正确的是( )
| A. | 制普通玻璃的原料主要是纯碱、石灰石和石英砂 | |
| B. | 玻璃在加热熔化时有固定的熔点 | |
| C. | 普通玻璃的主要成分中有硅酸钠、硅酸钙 | |
| D. | 盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起 |
10.(1)管道煤气与天然气是常用的民用燃料.管道煤气的主要成分是CO、H2和少量烃类.天然气的主要成分是CH4.则(1)燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是天然气.因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是增大进气口(填“增大”或“减小”),若不作任何改进,可能产生的不良结果是天然气不能充分燃烧,可能生成有毒的CO.
(2)管道煤气中含有烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是丁烷遇冷凝结为液体使管道内气流不畅.
(2)管道煤气中含有烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
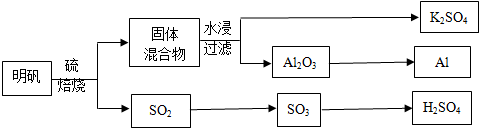

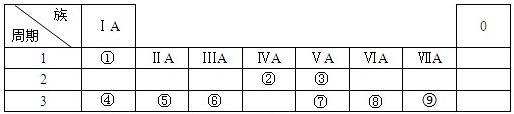
 ;元素的⑨离子结构示意图是
;元素的⑨离子结构示意图是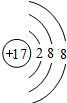 .
.