题目内容
7.实验室制取氯气时,若没有MnO2则用KMnO4代替,据此回答下列问题:(1)配平该反应
2KMnO4+16HCl$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+2MnCl2+5Cl2↑+8H2O
(2)被氧化的HCl与未被氧化的HCl的物质的量之比为5:3.
分析 (1)反应中锰从+7价变为+2价,氯从-1价变为0价,根据化合价升降法结合元素守恒配平化学方程式;
(2)被氧化的HCl生成了氯气,未被氧化的HCl氯元素的化合价未变,生成氯化钾和氯化锰,据此可判断被氧化的HCl与未被氧化的HCl的物质的量之比;
解答 解:(1)反应中锰从+7价变为+2价,氯从-1价变为0价,每生成1mol氯气得2mol电子,所以一个KMnO4生成MnCl2,得5个电子,生成一个C12分子需要2个氯离子失去2个电子,所以得失电子的最小公倍数是10,再根据元素守恒知,反应中的计量数分别为:2;16;2;2;5;8,
故答案为:2;16;2;2;5;8;
(2)根据(1)中的反应的各物质之间的关系可知,每16个HCl分子参加反应生成5个氯气分子,即有10个氯化氢分子被氧化,所以被氧化的HCl与未被氧化的HCl的物质的量之比10:6=5:3,
故答案为:5:3;
点评 本题考查了氧化还原反应的配平、氧化还原的计算等知识点,难度不大,注意准确理解被氧化的氯化氢与未被氧化的氯化氢之间的关系.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
17.北京时间9月25日21时10分04秒,我国航天事业又迎来一个历史性时刻,我国自行研制的神舟七号载人飞船在酒泉卫星发射中心发射升空,于28日下午回到美丽的地球.“神舟”七号汇集了大量最新科技,发射火箭的常规推进剂为四氧化氮和偏二甲肼(C2H8N2),5.00g C2H8N2完全燃烧可放出212.5kJ热量.下列叙述正确的是( )
| A. | 燃烧不一定有氧气参加,也不一定是放热反应 | |
| B. | 火箭点火后,喷出的红色火焰是金属的焰色反应产生的 | |
| C. | 火箭燃料燃烧主要是将化学能转变为热能和光能,可能对环境产生污染 | |
| D. | 偏二甲肼燃烧的热化学方程式是:C2H8N2(g)+2N2O4(g)═2N2(g)+2CO2(g)+4H2O(g);△H=-2550kJ/mol |
18.下列有关实验装置进行的相应实验,能达到实验目的是( )

| A. | 用图1所示装置除去Cl2中含有的少量HCl | |
| B. | 用图2所示装置由MgCl2溶液制备无水MgCl2晶体 | |
| C. | 用图3所示装置制取少量CO2气体 | |
| D. | 用图4所示装置除去溴苯中混有的少量Br2 |
2.吸毒危害之大,甚于洪水猛兽.下列不属于毒品的是( )
| A. | 鸦片 | B. | 海洛因 | C. | 冰毒 | D. | 苯甲酸钠 |
12.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 沸点:H2O>HF>HCl>HBr | ||
| C. | 稳定性:PH3<H2S<HCl | D. | 非金属性:F>O>S |
19.生活和生产涉及到化学知识,下列说法正确的是( )
| A. | Al(OH)3 是医用胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液pH降低,起到中和胃酸的作用. | |
| B. | 铝表面的氧化膜可以防止铝制品被进一步氧化,但是很多酸碱盐可以直接侵蚀铝表面的氧化膜以及铝制品本身,因此铝制品不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | |
| C. | 移动电话及笔记本电脑中使用的锂离子电池,聚合物锂离子电池等一系列新型二次电池具有供电方便,工作寿命长、自放电率低,记忆效应高等特点 | |
| D. | 很多金属及其化合物在灼烧时会使火焰呈现特殊的颜色,这种化学反应叫做焰色反应,节日燃放的五彩缤纷的烟花就是碱金属以及锶、钡等金属化合物的焰色反应所呈现的各种艳丽色彩 |
16.欲配制下列各组离子的溶液,能够实现的是( )
| A. | Cu2+、Br-、HCO3-、AlO2- | B. | Fe3+、K+、SCN-、SO42- | ||
| C. | Fe2+、NO3-、HSO3-、Ag+ | D. | Na+、AlO2-、K+、C6H5O- |
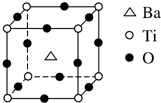 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: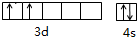 ;
;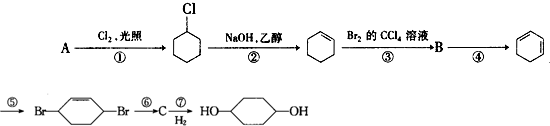

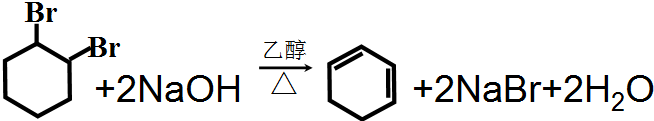 .反应⑥的化学方程式是
.反应⑥的化学方程式是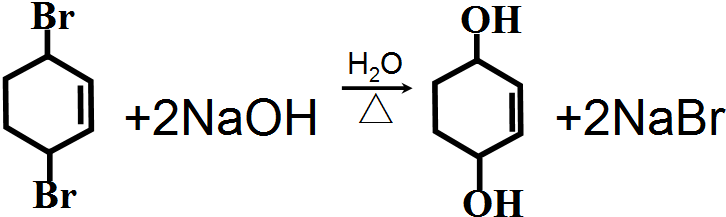 .
.