题目内容
4.标准状况下,NO2与O2以10:1充满烧瓶,倒立于水中最终还剩余气体,所得溶液的物质的量浓度为0.04mol/L.分析 二氧化氮、水和氧气反应方程式为4NO2+O2+2H2O=4HNO3,假设有10mol二氧化氮、1mol氧气,根据方程式知氧气完全反应还有二氧化氮剩余,1mol氧气完全反应需要4mol二氧化氮,同时生成4mol硝酸,还剩余6mol二氧化氮;
二氧化氮和水还发生反应,方程式为3NO2+H2O=2HNO3+NO,则6mol二氧化氮完全反应生成4mol硝酸同时生成2molNO,所以最终烧瓶中剩余2mol气体,则溶液加入烧瓶中体积是10mol气体占有的体积,据此计算物质的量浓度.
解答 解:二氧化氮、水和氧气反应方程式为4NO2+O2+2H2O=4HNO3,假设有10mol二氧化氮、1mol氧气,根据方程式知氧气完全反应还有二氧化氮剩余,1mol氧气完全反应需要4mol二氧化氮,同时生成4mol硝酸,还剩余6mol二氧化氮;
二氧化氮和水还发生反应,方程式为3NO2+H2O=2HNO3+NO,则6mol二氧化氮完全反应生成4mol硝酸同时生成2molNO,所以最终烧瓶中剩余2mol气体,则溶液加入烧瓶中体积是10mol气体占有的体积,溶质硝酸的物质的量=(4+4)mol=8mol,溶液体积=9mol×22.4L/mol=201.6L,
则溶液物质的量浓度=$\frac{8mol}{201.6L}$=0.04mol/L,
故答案为:0.04mol/L.
点评 本题考查物质的量浓度计算,为高频考点,明确溶液体积是解本题关键,利用方程式计算硝酸物质的量、物质的量浓度公式分析解答即可,题目难度不大.

练习册系列答案
相关题目
14.某有机物样品3.1g完全燃烧,无论何种比例混合,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g,经过滤后得到10g沉淀.该有机物样品可能是( )
①乙二醇 ②乙醇 ③乙醛 ④甲醇和丙三醇的混合物.
①乙二醇 ②乙醇 ③乙醛 ④甲醇和丙三醇的混合物.
| A. | ①② | B. | ① | C. | ①④ | D. | ④ |
12.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 沸点:H2O>HF>HCl>HBr | ||
| C. | 稳定性:PH3<H2S<HCl | D. | 非金属性:F>O>S |
19.生活和生产涉及到化学知识,下列说法正确的是( )
| A. | Al(OH)3 是医用胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液pH降低,起到中和胃酸的作用. | |
| B. | 铝表面的氧化膜可以防止铝制品被进一步氧化,但是很多酸碱盐可以直接侵蚀铝表面的氧化膜以及铝制品本身,因此铝制品不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | |
| C. | 移动电话及笔记本电脑中使用的锂离子电池,聚合物锂离子电池等一系列新型二次电池具有供电方便,工作寿命长、自放电率低,记忆效应高等特点 | |
| D. | 很多金属及其化合物在灼烧时会使火焰呈现特殊的颜色,这种化学反应叫做焰色反应,节日燃放的五彩缤纷的烟花就是碱金属以及锶、钡等金属化合物的焰色反应所呈现的各种艳丽色彩 |
9.交警检测酒后驾车的原理是:2K2Cr2O7+3C2H5OH+8H2SO4═2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O(橙色的K2Cr2O7生成绿色的Cr3+).对该反应的叙述正确的是( )
| A. | 乙醇在该反应中表现为氧化性 | B. | 反应中Cr元素被还原 | ||
| C. | 该反应不是氧化还原反应 | D. | 该反应时复分解反应 |
16.欲配制下列各组离子的溶液,能够实现的是( )
| A. | Cu2+、Br-、HCO3-、AlO2- | B. | Fe3+、K+、SCN-、SO42- | ||
| C. | Fe2+、NO3-、HSO3-、Ag+ | D. | Na+、AlO2-、K+、C6H5O- |
15.下列物质中,在一定条件下既能发生加成反应,也能发生取代反应,但不能使酸性KMnO4溶液褪色的是( )?
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
16.下列关于苯酚的叙述中,错误的是( )
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 氯化铁溶液中滴入苯酚的水溶液后,溶液呈紫色 |
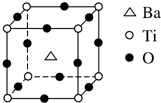 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: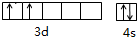 ;
;