题目内容
11.填空:(1)5mol O2中含有6.02×1024个O;
(2)3mol Ba(OH)2中含有1.806×1024个Ba(OH)2,可电离出6mol OH-;
(3)0.4mol CH4含有1.204×1024个原子,4mol质子;
(4)1.5mol OH-中含有8.127×1024个质子,9.03×1024个e-.
分析 (1)氧原子物质的量为氧气的2倍,再根据N=nNA计算氧原子数目;
(2)根据N=nNA计算Ba(OH)2数目,氢氧根离子物质的量为氢氧化钡的2倍;
(3)原子物质的量为甲烷5倍,电子物质的量为甲烷的10倍,再根据N=nNA计算;
(4)质子物质的量为氢氧根离子的9倍,电子物质的量为氢氧根离子10倍,再根据N=nNA计算.
解答 解:(1)5mol O2中含有O原子数目为5mol×2×6.02×1023mol-1=6.02×1024,
故答案为:6.02×1024;
(2)Ba(OH)2数目为3mol×6.02×1023mol-1=1.806×1024,电离出氢氧根离子为3mol×2=6mol,
故答案为:1.806×1024;6;
(3)0.4mol CH4含有原子数目为0.4mol×5×6.02×1023mol-1=1.204×1024,含有质子物质的量为0.4mol×10=4mol,
故答案为:1.204×1024;4;
(4)1.5mol OH-中含有质子数目为1.5mol×9×6.02×1023mol-1=8.127×1024,含有e-数目为1.5mol×10×6.02×1023mol-1=9.03×1024,
故答案为:8.127×1024;9.03×1024.
点评 本题考查物质的量有关计算,侧重考查微粒数目的计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”--全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: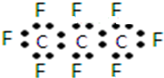 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 全氟丙烷分子是既有极性键又有非极性键的极性分子 |
2.吸毒危害之大,甚于洪水猛兽.下列不属于毒品的是( )
| A. | 鸦片 | B. | 海洛因 | C. | 冰毒 | D. | 苯甲酸钠 |
19.生活和生产涉及到化学知识,下列说法正确的是( )
| A. | Al(OH)3 是医用胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液pH降低,起到中和胃酸的作用. | |
| B. | 铝表面的氧化膜可以防止铝制品被进一步氧化,但是很多酸碱盐可以直接侵蚀铝表面的氧化膜以及铝制品本身,因此铝制品不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | |
| C. | 移动电话及笔记本电脑中使用的锂离子电池,聚合物锂离子电池等一系列新型二次电池具有供电方便,工作寿命长、自放电率低,记忆效应高等特点 | |
| D. | 很多金属及其化合物在灼烧时会使火焰呈现特殊的颜色,这种化学反应叫做焰色反应,节日燃放的五彩缤纷的烟花就是碱金属以及锶、钡等金属化合物的焰色反应所呈现的各种艳丽色彩 |
6.常温下能与硅反应的是( )
①O2 ②Cl2 ③F2 ④H2 ⑤NaOH溶液 ⑥H2O.
①O2 ②Cl2 ③F2 ④H2 ⑤NaOH溶液 ⑥H2O.
| A. | ①②③ | B. | ①②③⑤ | C. | ③⑤ | D. | 除⑥外 |
16.欲配制下列各组离子的溶液,能够实现的是( )
| A. | Cu2+、Br-、HCO3-、AlO2- | B. | Fe3+、K+、SCN-、SO42- | ||
| C. | Fe2+、NO3-、HSO3-、Ag+ | D. | Na+、AlO2-、K+、C6H5O- |
5.铝具有较强的抗腐蚀能力,主要原因是( )
| A. | 铝的化学性质稳定 | B. | 铝与氧气常温下不反应 | ||
| C. | 铝是两性元素 | D. | 铝与氧化合形成一层致密的氧化膜 |
3.下列叙述正确的是( )
| A. | 可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力 | |
| B. | 常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大 | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量共存 | |
| D. | 等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |