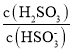��Ŀ����
����Ŀ������β���е�NO(g)�ǵ��¹⻯ѧ�������ƻ����������ҪԴͷ֮һ�����������з�������NO����������ش��������⣺
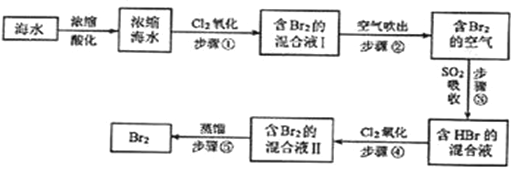
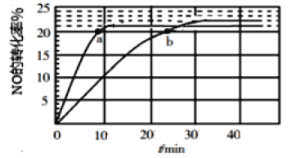
(1)����ij�ִ������ֽ�NO��������Ӧ2NO(g)![]() N2(g)��O2(g)����T1���T2��ʱ(T1>T2)NO��ת������ʱ��仯�Ľ����ͼ��ʾ��
N2(g)��O2(g)����T1���T2��ʱ(T1>T2)NO��ת������ʱ��仯�Ľ����ͼ��ʾ��
�ٷ�Ӧ2NO(g)![]() N2(g)��O2(g)Ϊ____________(��������������������)��Ӧ��
N2(g)��O2(g)Ϊ____________(��������������������)��Ӧ��
��T2��ʱ����Ӧ��ƽ�ⳣ��K��__________(����2λС��)��
����T1���£�Ҫ���NOת���ʣ��ɲ�ȡ�Ĵ�ʩ��_________________________
�ܱȽ�a��b����Ӧ���ʴ�С����a(��)________��b(��)(������������С��������������)����֪��Ӧ����������k��x2(NO)��������k��x(N2)��x(O2)��k����k���ֱ�Ϊ��������Ӧ���ʳ�����xΪ���ʵ�������������b�㴦![]() ��__________(����1λС��)��
��__________(����1λС��)��
(2)����Ҳ�����ڴ���NO��O3����NO���ˮϴ�ɲ���HNO3��O2��������1 mol��HNO3��ת��_______ mol���ӡ�
(3)O3���ɵ��ϡ�����Ƶã�ԭ������ͼ��ʾ��ͼ������Ϊ________(����A������B��)������(���Ե缫)�ĵ缫��ӦʽΪ___________________________________��

���𰸡����� 0.02 �跨ȡ��һ���������� ���� 1.3 3 B 3H2O-6e-=O3��+6H+
��������
(1)��ͼ�п��Կ������������ߴ�ƽ���ʱ�䲻ͬ����ΪT1>T2�������ȴ�ƽ�������ΪT1��ʱ�����ߡ�
�ٴ�NO��ת���ʿ��Կ������¶ȵ�ʱת���ʴ�����ƽ�������ƶ����ɴ˵ó�2NO(g)![]() N2(g)��O2(g)�ķ�Ӧ��ЧӦ��
N2(g)��O2(g)�ķ�Ӧ��ЧӦ��
��T2��ʱ��NO��ת����Ϊ22%����������ʽ����ƽ������ϵ���������Ӧ��ƽ�ⳣ��K��
����T1���£�Ҫ���NOת���ʣ��ɴӸı��¶ȼ��������Ũ��Ѱ�Ҵ�ʩ��
�ܱȽ�va(��)��vb(��)ʱ���ɴ��¶ȷ������ȴ�ƽ��㣬����v��=v�����![]() ��Ȼ���������ʹ�ʽ������b�㴦
��Ȼ���������ʹ�ʽ������b�㴦![]() ��
��
(2)����Ҳ�����ڴ���NO��O3����NO���ˮϴ�ɲ���HNO3��O2��������1 mol��HNO3���������NԪ�صļ�̬�仯��ȷ��ת�Ƶ��ӵ����ʵ�����
(3)O3���ɵ��ϡ�����Ƶã���������H2���ɴ�ȷ��ͼ����������������ˮʧ��������O3�ķ�Ӧ��
(1)��ͼ�п��Կ������������ߴ�ƽ���ʱ�䲻ͬ����ΪT1>T2�������ȴ�ƽ�������ΪT1��ʱ�����ߡ�
�ٴ�NO��ת���ʿ��Կ������¶ȵ�ʱת���ʴ�����ƽ�������ƶ����ɴ˵ó�2NO(g)![]() N2(g)��O2(g)Ϊ���ȷ�Ӧ����Ϊ�����ȣ�
N2(g)��O2(g)Ϊ���ȷ�Ӧ����Ϊ�����ȣ�
��T2��ʱ�����ڸ÷�Ӧ��Ӧǰ��ѧ��������ȣ���NO����ʼ���ʵ���Ϊ2mol���������ݻ�Ϊ1L��

��Ӧ��ƽ�ⳣ��K=![]() =0.02����Ϊ��0.02��
=0.02������0.02��
����T1���£���Ϊ�Ӵ������ı�ѹǿ��������ʹƽ�ⷢ���ƶ�������Ҫ���NOת���ʣ�ֻ�ܴ��������Ũ��Ѱ�Ҵ�ʩ���ʿɲ�ȡ�Ĵ�ʩ���跨ȡ��һ�����������Ϊ���跨ȡ��һ���������
����Ϊa����¶ȸ���b�㣬����va(��)> vb(��)��T2��ƽ��ʱv��=v����x��NO��=0.78��x��N2��=x��O2��=0.11����k����0.782=k����0.11��0.11����![]() =0.02����b��ʱ������ʽ��ϵ���£�
=0.02����b��ʱ������ʽ��ϵ���£�

��ʱx��NO��=0.8��x��N2��=x��O2��=0.1��b��ʱ��![]() =
=![]() =0.02��82=1.3������>��1.3��
=0.02��82=1.3������>��1.3��
(2)O3����NO���ˮϴ�ɲ���HNO3��O2����Ӧ����ʽΪ3O3+2NO+H2O=2HNO3+3O2��������1 mol��HNO3����NԪ����+2�����ߵ�+5�ۣ�ת�Ƶ��ӵ����ʵ���Ϊ3mol����Ϊ��3��
(3)O3���ɵ��ϡ�����Ƶã���������H2���ɴ�ȷ��ͼ������ΪB��AΪ����������������ӦΪ3H2O-6e-=O3��+6H+����Ϊ��B��3H2O-6e-=O3��+6H��

����Ŀ��25��ʱ�����ʵ���Ũ�Ⱦ�Ϊ0.1molL��1�ļ�������Һ��pH�����
��� | �� | �� | �� | �� | �� |
��Һ | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)�����ӷ���ʽ������Һ����ȥ�����۵�ԭ��_____��
(2)д����Һ����ͨ����CO2�����ӷ���ʽ��_____��
(3)25��ʱ����Һ���У���ˮ���������c(H+)=_____molL��1��
(4)��0.100molL-1NH4HCO3��Һ�����ʵ���Ũ������������__________(�ѧʽ)����CH3COOH��NaOH��Ӧ�����Һ�д��ڣ�c(Na+)��c(CH3COO-)������Һ��_________��(����������������������)������Һ��������______��(�ѧʽ)
(5)����˵����ȷ����_____��
a.c(NH4+)���٣���
b.���ʵ���Ũ�Ⱥ��������ȵ�NaCl��NaX������Һ�У������������
c.������Ģۺ͢��γɵĻ����Һ�У�c(HCO3��)+c(CO32��)=0.1molL��1
d.��pH��ͬ��CH3COOH��HX��Һ��ˮϡ����ͬ������HX��Һ��pH�仯С
(6)ijͬѧ����0.1molL��1 CaCl2��Һ��������Һ�ۺ͢ݣ�������CaCl2��Һ����װ����Һ�۵��Թ���ʱ�����������벻���������Թ��г����˰�ɫ�������������������ɡ��Խ��Ͳ������������ԭ��_____��