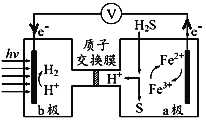
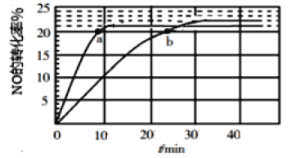
题目内容
【题目】醋酸在水溶液中存在下列电离平衡:CH3COOH![]() CH3COO+H+,下列说法不正确的是
CH3COO+H+,下列说法不正确的是
A.加入醋酸钠晶体后,溶液的pH增大
B.加入碳酸钠,平衡向右移动
C.加水稀释,溶液中c(H+)和c(OH-)均减少
D.升高温度,Ka(CH3COOH)增大
【答案】C
【解析】
从影响弱电解质电离的因素以及离子积的角度进行分析解答。
A、加入CH3COONa,溶液中c(CH3COO-)增大,抑制醋酸的电离,溶液中c(H+)减小,pH增大,故A说法正确;
B、醋酸的酸性强于碳酸,CO32-能与H+反应,促进电离,平衡向右移动,故B说法正确;
C、加水稀释,促进电离,但c(H+)降低,根据水的离子积,c(OH-)增大,故C说法错误;
D、电离平衡常数只受温度的影响,弱电解质的电离是吸热过程,升高温度,促进电离,电离平衡常数增大,故D说法正确;
答案为C。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目