题目内容
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
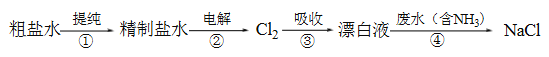
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
【答案】D
【解析】A. ①中采用蒸馏只能得到蒸馏水,得不到精制盐水,要得到精制盐水需要使用化学方法除去其中的杂质,故A错误;B. 阳极发生氧化反应,②中阳极的主要电极反应:2Cl――2e-=Cl2↑,故B错误;C. 生成的氯气与氢氧化钠反应生成次氯酸钠,③中制备漂白液的反应:Cl2 + 2OH- = Cl- + ClO- + H2O,故C错误;D. ②中电解氯化钠溶液生成氢气和氯气以及氢氧化钠、③中氯气与氢氧化钠反应生成氯化钠和次氯酸钠、④中次氯酸钠与氨气反应生成氮气和氯化钠,均存在元素化合价的变化,发生了氧化还原反应,故D正确;故选D。

练习册系列答案
相关题目
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
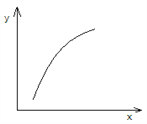
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |