题目内容
4. (1)下列反应属于吸热反应的是DE
(1)下列反应属于吸热反应的是DEA.C6H12O6(葡萄糖)+6O2═6CO2+6H2O
B.CH3COOH+KOH═CH3COOK+H2O
C.大多数化合反应
D.破坏生成物全部化学键所需能量小于破坏反应物全部化学键的能量
E.Ba(OH)2•8H2O晶体与NH4Cl晶体反应
F.金属与酸或水的反应
(2)在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)?C(g)+D(g),能表明反应已达平衡状态的是BE
A.混合气体的压强不变
B.混合气体的密度不变
C.单位时间内生成n molC的同时生成n mol D
D.气体总物质的量不变
E.A的物质的量不再变化
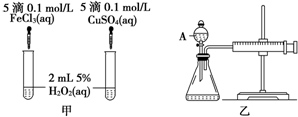
(3)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡快慢来定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为分液漏斗,实验中需要测量的数据是收集40mL气体所需要的时间.检查乙装置气密性的方法是关闭A上的玻璃旋塞,将针筒的活塞拉出(或推进)一段后松开,活塞能回到原来的位置说明气密性良好.
分析 (1)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解反应以及某些复分解(如铵盐和强碱);
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)①根据反应生成气体的快慢分析;根据阴阳离子判断;
②该反应是通过反应速率分析的,所以根据v=$\frac{△V}{△t}$判断.
解答 解:(1)A、葡萄糖被氧化放出大量的热,则属于放热反应,故A错误;
B、CH3COOH+和KOH反应放出大量的热,则属于放热反应,故B错误;
C、大多数化合反应放出热量,故C错误;
D、破坏生成物全部化学键所需能量小于破坏反应物全部化学键的能量,需要吸收能量,属于吸热反应,故D正确;
E、Ba(OH)2•8H2O晶体与NH4Cl晶体反应吸收热量,则属于吸热反应,故E正确;
F、金属与酸或水的反应放出热量,属于放热反应,故F错误;
故答案为:DE;
(2)A、随着反应的进行体系压强不变,容器内压强保持不变,不一定达平衡状态,故A错误;
B、混合气体的密度不变,说明气体的质量不变,即正逆反应速率相等,故B正确;
C、单位时间内生成n molC的同时生成n mol D,都是正反应方向,反应不一定达到化学平衡状态,故C错误;
D、反应体系中气体的物质的量是一定值,不一定平衡,故D错误;
E、A的物质的量不再变化,反应达到化学平衡状态,故E正确;
故答案为:BE;
(3)①该反应中产生气体,所以可根据生成气泡的快慢判断,氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用;硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,
故答案为:反应产生气泡的快慢;控制阴离子相同,排除阴离子的干扰;
②由装置图可知,A是分液漏斗;该反应是通过生成气体的反应速率分析判断的,所以根据v=$\frac{△V}{△t}$判知,需要测量的数据是产生40ml气体所需要的时间;检查乙装置气密性的方法是:关闭A上的玻璃旋塞,将针筒的活塞拉出(或推进)一段后松开,活塞能回到原来的位置说明气密性良好;故答案为:分液漏斗;收集40mL气体所需要的时间;关闭A上的玻璃旋塞,将针筒的活塞拉出(或推进)一段后松开,活塞能回到原来的位置说明气密性良好.
点评 本题考查了吸热反应与放热反应的区别、化学平衡状态的标志、催化剂的作用及化学反应速率的影响因素等知识点,难度不大,要会分析将FeCl3改为Fe2(SO4)3更为合理的理由.

| A. | 由Zn和稀H2SO4反应制取氢气 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
| A. | 0.1mol•L-1CH3COOH与0.1mol•L-1氨水等体积混合(PH=7):c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1mol•L-1HCl溶液与0.2mol•L-1氨水等体积混合(PH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1mol•L-1CH3COONa与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1 NaHCO3溶液等体积混合:c(HCO3-)>0.05mol•L-1>c(CO32-)>c(OH-) |
| A. | 加热氯化铁溶液,溶液颜色变深与盐类水解有关 | |
| B. | NaHS溶液水解方程式为:HS-+H2O?H2S+OH- | |
| C. | Na2SO3溶液中,c(OH-)=c(H+)+c(HSO3-)+c(H2SO3) | |
| D. | 0.1 mol•L-1的CH3COOH溶液和0.1 mol•L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |

| A. | 当闭合开关S1,断开开关S2,右石墨棒发生的电极反应为:2H2O-4e-=4H++O2↑ | |
| B. | 石墨棒使用前在高温火焰上灼烧至红热,迅速浸入冷水,可以使表面粗糙多空,吸附更多的气体 | |
| C. | 先闭合开关S1,一段时间后断开,再闭合S2,可以观察到发光二级管发光 | |
| D. | 断开S2,闭合S1,更换电解质,可以用来模拟工业制氯气,粗铜冶炼制精铜 |
| A. | 加热使c(H+)增大 | B. | 投入一小块金属钠 | ||
| C. | 加入少量NH4Cl固体 | D. | 以铁为电极进行电解 |
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol•L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
②下列关于0.1mol•L?1NaHC2O4溶液的说法正确的是ad.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是BD.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)?Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)

(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色粉末变红色.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为Fe2O3.草酸亚铁晶体分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3CO↑+CO2↑+2H2O.