题目内容
【题目】铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是
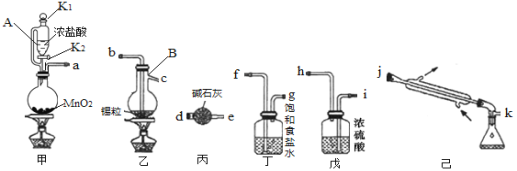
A.通过调节分液漏斗的活塞以控制①中气泡产生快慢
B.装置①的作用是干燥氢气
C.装置②、③中的药品分别是无水硫酸铜、碱石灰
D.加热装置Y前,应先让X反应一段时间,排除装置中的空气
【答案】C
【解析】
根据实验目的“探究用氢气和碳酸亚铁制取铁粉并检验反应产物”,结合装置图分析可知,X装置为Zn和稀硫酸发生置换反应制备H2的装置,①装置盛有浓硫酸干燥H2,Y装置为氢气和碳酸亚铁制取铁粉的装置,②为检验产物H2O的装置,可盛装白色的无水硫酸铜固体,③装置的主要目的是吸收H2O并防止④中的H2O进入②装置中造成干扰,可以是无水CaCl2,④为检验CO2的装置,据此分析解答问题。
A.根据上述分析,X装置为Zn和稀硫酸发生置换反应制备H2的装置,分液漏斗可调节稀硫酸的滴入速率从而控制①中气泡产生快慢,A选项正确;
B.①装置盛有浓硫酸干燥H2,防止对后面产物的检验产生干扰,B选项正确;
C.由上述分析可知,②为检验产物H2O的装置,可盛装白色的无水硫酸铜固体,③装置的主要目的是吸收H2O并防止④中的H2O进入②装置中造成干扰,可以是无水CaCl2或无水硫酸铜,但碱石灰会吸收CO2,不能是碱石灰,C选项错误;
D.H2与空气混合加热易发生爆炸,故在加热装置Y前,应先让X反应一段时间,排除装置中的空气,D选项正确;
答案选C。

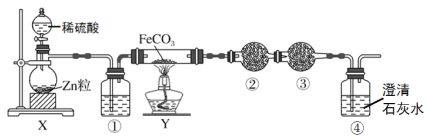
【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入 一段时间N2,关闭K1 | _________ |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3―传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,_________;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量氧气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:
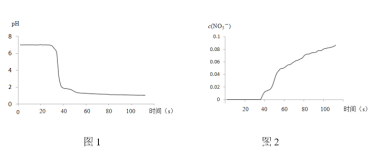
(解释及结论)
(1)NO2与水反应的离子方程式为____________ 。
(2)步骤I中,通入N2的目的是____________。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:____________。
(4)该实验验证NO2与水反应产物的实验证据包括____________(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.![]() 传感器记录所得数据
传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果____________
【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是元素周期表中5种元素的相关信息,其中Q、W、X位于同一周期。
元素 | 信息 |
Q | 地壳中含量第2的元素 |
W | 最高正化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色反应为紫色 |
Z | 原子结构示意图为 |
(1)Q在元素周期表中的位置是___________。
(2)Q、W的最高价氧化物对应的水化物中,酸性较强的物质是___________。(填化学式)
(3)金属性Y强于X,用原子结构解释原因:___________,失电子能力Y大于X。(用元素符号回答问题)
(4)下列对于Z及其化合物的推断中,正确的是___________(填序号)。
①Z的最低负化合价与W的最低负化合价相同
②Z的氢化物的稳定性弱于W的氢化物的稳定性
③Z的单质可与X和W形成的化合物的水溶液发生置换反应
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 H2SO4溶液
(1)若配制250 mL H2SO4溶液,则需量筒量取密度为1.84 g·cm-3,质量分数为98%的浓硫酸____mL。
Ⅱ.测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示:
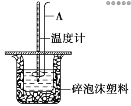
(2)仪器A的名称为___________。
(3)写出表示该反应中和热的热化学方程式:__________________。
(4)取50 mL NaOH溶液和30 mL H2SO4溶液进行实验,实验数据如下表。
实验 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差的平均值为____
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=___________(取小数点后一位)。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)碎泡沫塑料的作用是___________。