题目内容
【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
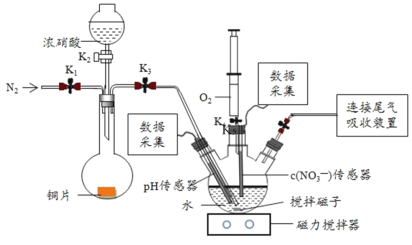
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入 一段时间N2,关闭K1 | _________ |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3―传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,_________;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量氧气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:
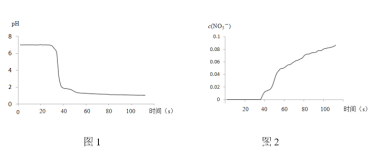
(解释及结论)
(1)NO2与水反应的离子方程式为____________ 。
(2)步骤I中,通入N2的目的是____________。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:____________。
(4)该实验验证NO2与水反应产物的实验证据包括____________(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.![]() 传感器记录所得数据
传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果____________
【答案】3NO2+H2O=2H++2NO3-+NO 除去空气中氧气,防止生成的NO被氧化 液面上方充满红棕色气体 BCD NO2中混有挥发的HNO3
【解析】
先向装置内通入氮气,除去空气中氧气,再利用浓硝酸和Cu作用制取NO2气体,并通入三颈烧瓶中与水反应,通过pH传感器和NO3-传感器检验有硝酸生成,利用针筒内氧气检验NO气体的生成。
(1)NO2与水反应生成硝酸和NO,反应的离子方程式为3NO2+H2O=2H++2NO3-+NO;
(2)步骤I中,通入N2的目的是除去空气中氧气,防止生成的NO被氧化;
(3)由Cu+4HNO3=Cu(NO3)2+2NO2↑+4H2O可知步骤II中圆底烧瓶内的实验现象为圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,液面上方充满红棕色气体;
(4)A.NO2与水反应生成硝酸和NO,与圆底烧瓶中溶液变为蓝绿色无关,故A错误;
B.三颈瓶内的气体从无色变为浅红棕色,说明NO和O2反应生成NO2,故B正确;
C.pH传感器记录所得数据显示反应后溶液显酸性,说明有酸生成,故C正确;
D.NO3-传感器记录所得数据显示反应后溶液中有NO3-生成,结合溶液显酸性,说明反应生成HNO3,故D正确;
故答案为BCD。
(5)浓硝酸有挥发性,未除去NO2中混有的HNO3,则无法根据传感器所记录的数据判断NO2溶于水生成硝酸,这是该实验不严谨的地方。

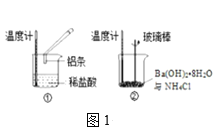
【题目】用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
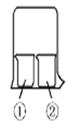
①中的物质 | ②中的物质 | 预测①中现象 | |
A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D