题目内容
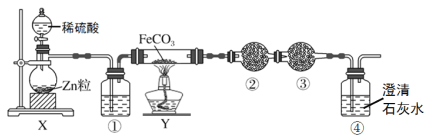
【题目】化合物甲由四种元素组成。某化学研究小组按如图流程探究其组成:

已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一。请回答下列问题:
(1)甲的化学式为____。
(2)甲发生爆炸反应的化学方程式为____。
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,则爆炸反应中被氧化的元素与还原产物的物质的量之比为____。
【答案】AgOCN 2AgOCN=2Ag+N2↑+2CO↑ 1:2
【解析】
已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一,由此可知丁是氮气,丙是一氧化碳。根据流程图可知氮气的物质的量为0.01mol,一氧化碳的物质的量为n(CO)= ![]() ,由此可知甲中C、N、O的原子个数比为1:1:1,化合物由四种元素组成,已知化合物中有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,撞击甲容易发生爆炸生成三种物质,则甲中应该有一种金属元素,设甲的化学式为R(CNO)x,R的相对原子质量为M,根据反应2R(CNO)x=2R+2xCO+xN2,有
,由此可知甲中C、N、O的原子个数比为1:1:1,化合物由四种元素组成,已知化合物中有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,撞击甲容易发生爆炸生成三种物质,则甲中应该有一种金属元素,设甲的化学式为R(CNO)x,R的相对原子质量为M,根据反应2R(CNO)x=2R+2xCO+xN2,有![]() ,所以M=108x,设x=1,2,3,……,当x=1时,M=108,R为银元素,当x取2、3……时,没有对应的金属元素的相对原子质量符合要求,所以甲为AgOCN。
,所以M=108x,设x=1,2,3,……,当x=1时,M=108,R为银元素,当x取2、3……时,没有对应的金属元素的相对原子质量符合要求,所以甲为AgOCN。
(1)由分析可知,甲的化学式为AgOCN,故答案为:AgOCN;
(2)由分析可知,乙为银单质,丙为一氧化碳,丁为氮气,则甲发生爆炸反应的化学方程式为2AgOCN=2Ag+N2↑+2CO↑,故答案为:2AgOCN=2Ag+N2↑+2CO↑;
(3)根据爆炸反应方程式可知,爆炸反应中被氧化的元素为氮元素,共2mol,还原产物为银单质和一氧化碳,共4mol,则爆炸反应中被氧化的元素与还原产物的物质的量之比为1:2,故答案为:1:2。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案