题目内容
【题目】CH4-CO2的催化重整不仅可以得到合成气(CO和H2)。还对温室气体的减排具有重要意义。
CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)= CH4(g) △H=-75 kJ/mol
C(s)+O2(g)=CO2(g) △H=-394 kJ/mol
C(s)+![]() O2(g)= CO(g) △H=-111 kJ/mol
O2(g)= CO(g) △H=-111 kJ/mol
该催化重整的热化学反应方程式是__________。
【答案】CH4(g)+CO2(g)=2CO(g)+2H2(g),△H =+247 kJ/mol
【解析】
给三个方程式进行编号,然后根据盖斯定律,将三个热化学方程式进行叠加,就可以得到相应的热化学方程式。
根据盖斯定律可知:反应过程中的能量变化只与反应的始态和终态有关,而与反应途径无关。① C(s)+2H2(g)= CH4(g) △H=-75 kJ/mol
② C(s)+O2(g)=CO2(g) △H=-394 kJ/mol
③C(s)+![]() O2(g)= CO(g) △H=-111 kJ/mol
O2(g)= CO(g) △H=-111 kJ/mol
将方程式2×③-①-②,整理可得得CH4(g)+CO2(g)=2CO(g)+2H2(g),△H=2×(-111kJ/mol)-(-75kJ/mol)-(-394kJ/mol)=+247kJ/mol;

【题目】在2L密闭容器中充入气体A和B,发生A(g)+B(g)C(g)+2D(g) ΔH,所得实验数据如表。下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 300 | 0.40 | 0.10 | 0.090 |
② | 500 | 0.40 | 0.10 | 0.080 |
③ | 500 | 0.20 | 0.05 | a |
A.ΔH>0
B.500 ℃该反应的平衡常数K=0.16 mol·L-1
C.③中达到平衡时,A的转化率大于20%
D.5min末测得①中n(C)=0.050 mol,则0到5min内v(D)=0.02mol·L-1·min-1
【题目】用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
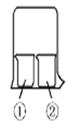
①中的物质 | ②中的物质 | 预测①中现象 | |
A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D
【题目】工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是_____,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是_____。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
共价键 | H-H | N≡N | N-H |
键能(kJ/mol) | 436 | 946 | 391 |
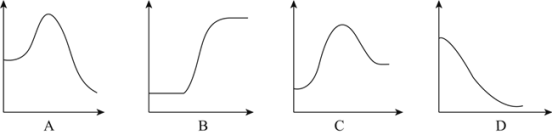
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是_____。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因_____。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有_____。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式_________________、_________________。