题目内容
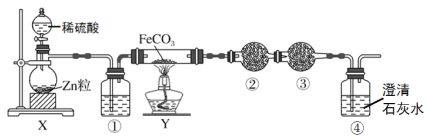
【题目】四氯化锡常温下呈液态,熔点-33℃,沸点144℃,在潮湿的空气中能强烈水解生成金属氧化物并产生有刺激性的白色烟雾,可用作媒染剂、催化剂等。实验室利用如图所示装置制备四氯化锡(夹持装置略)。
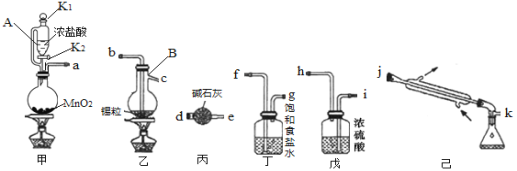
回答下列问题:
(1)甲装置中发生反应的离子方程式为_________,仪器B的名称是_____。
(2)按照气流方向连接装置,接口顺序为_________。
(3)实验开始时需向圆底烧瓶中缓慢滴加浓盐酸,此时应打开仪器A的活塞_____(填“K1”、“K2”或“K1和K2”)。排尽装置中的空气后才能点燃乙处的酒精灯,判断装置中空气已排尽的现象是______。实验结束时,应先停止加热的装置是_____(填“甲”或“乙”)。
(4)丙装置的作用是_____,若没有丙装置,可能发生的化学反应方程式为____。
(5)实验制得30g溶有氯气的SnCl4,其中氯气质量分数为13.0%,则至少需向乙中通入标准状况的氯气_______L (保留2位小数) 。提纯该SnCl4的方法是______(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
【答案】MnO2 +4H+ +2Cl-![]() Mn2+ + 2H2O + Cl2↑ 蒸馏烧瓶 afgihbcjkd K2 装置中充满黄绿色气体 乙 吸收多余的氯气,并防止水蒸气进入锥形瓶 SnCl4 +2H2O =SnO2+ 4HCl↑ 5.71 d
Mn2+ + 2H2O + Cl2↑ 蒸馏烧瓶 afgihbcjkd K2 装置中充满黄绿色气体 乙 吸收多余的氯气,并防止水蒸气进入锥形瓶 SnCl4 +2H2O =SnO2+ 4HCl↑ 5.71 d
【解析】
由题干信息可知,Cl2和Sn在加热的条件下可制得SnCl4,装置甲为Cl2的制备装置,乙装置为Cl2和Sn制备SnCl4的装置,丙装置中装有碱石灰可吸收氯气和空气中的水蒸气,丁装置可吸收挥发的浓盐酸,戊装置为吸收水蒸气,干燥Cl2的装置,己装置为冷凝并收集SnCl4的装置,据此可分析解答。
(1)根据上述分析可知,装置甲为MnO2和浓盐酸在加热的条件下制备Cl2的装置,其反应的离子方程式为MnO2 +4H+ +2Cl-![]() Mn2+ + 2H2O + Cl2↑,仪器B是蒸馏烧瓶,一般用于蒸馏操作,故答案为:MnO2 +4H+ +2Cl-
Mn2+ + 2H2O + Cl2↑,仪器B是蒸馏烧瓶,一般用于蒸馏操作,故答案为:MnO2 +4H+ +2Cl-![]() Mn2+ + 2H2O + Cl2↑;蒸馏烧瓶;
Mn2+ + 2H2O + Cl2↑;蒸馏烧瓶;
(2)由上述装置分析知,装置顺序为甲→丁→戊→乙→己→丙,若按照气流方向连接装置,气体在通过吸气瓶时要长进短出,则其接口顺序为afgihbcjkd,故答案为:afgihbcjkd;
(3)仪器A为恒压滴液漏斗,有着平衡气压使液体顺利滴下的作用,若要向圆底烧瓶中缓慢滴加浓盐酸,只需打开仪器A的活塞K2,当装置中充满了黄绿色的Cl2后,可证明装置中空气已经排尽,反应结束时,为防止发生倒吸,应先停止加热装置乙,再停止加热装置甲,故答案为:K2;装置中充满黄绿色气体;乙;
(4)丙装置中的碱石灰既可吸收多余的氯气,防止污染空气,又可以防止空气中的水蒸气进入锥形瓶,使的SnCl4水解,若没有丙装置,SnCl4水解生成金属氧化物SnO2并产生有刺激性的白色烟雾HCl,方程式为SnCl4 +2H2O =SnO2+ 4HCl↑,故答案为:吸收多余的氯气,并防止水蒸气进入锥形瓶;SnCl4 +2H2O =SnO2+ 4HCl↑;
(5)30g氯气质量分数为13.0%的SnCl4中,SnCl4的质量为30×(1-13%)=26.1g,其物质的量为0.1mol,则SnCl4中Cl元素的质量为0.1×4×35.5=14.2g,Cl2的质量为30×13%=3.9g,即Cl2中Cl元素的质量为3.9g,故需要的Cl元素的总质量为14.2+3.9=18.1g,物质的量为18.1g÷35.5g/mol≈0.51mol,则需要的Cl2的物质的量为0.225mol,标况下的体积为0.225mol×22.4L/mol≈5.71L,四氯化锡常温下呈液态,熔点-33℃,沸点144℃,则可采用蒸馏的方法提纯SnCl4,d选项正确,故答案为:5.71;d。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】在2L密闭容器中充入气体A和B,发生A(g)+B(g)C(g)+2D(g) ΔH,所得实验数据如表。下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 300 | 0.40 | 0.10 | 0.090 |
② | 500 | 0.40 | 0.10 | 0.080 |
③ | 500 | 0.20 | 0.05 | a |
A.ΔH>0
B.500 ℃该反应的平衡常数K=0.16 mol·L-1
C.③中达到平衡时,A的转化率大于20%
D.5min末测得①中n(C)=0.050 mol,则0到5min内v(D)=0.02mol·L-1·min-1
【题目】用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
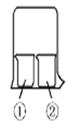
①中的物质 | ②中的物质 | 预测①中现象 | |
A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D
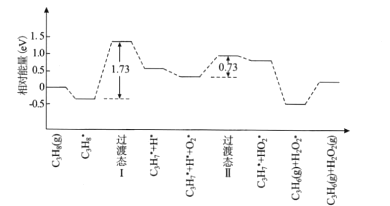
【题目】工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
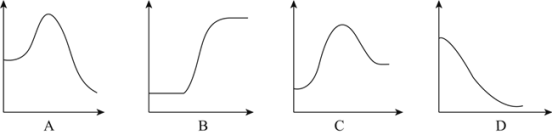
(1)N2分子通常条件下非常稳定,其本质原因是_____,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是_____。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
共价键 | H-H | N≡N | N-H |
键能(kJ/mol) | 436 | 946 | 391 |
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是_____。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因_____。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有_____。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式_________________、_________________。
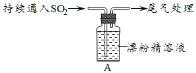
【题目】某小组对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.出现浑浊,溶液变为黄绿色; ⅱ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是_________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是______________________。
(3)甲同学认为现象i中溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是___________________。
(4)乙同学通过实验确定了A瓶中大量白色沉淀是CaSO4,并用离子方程式解释了现象ⅱ中黄绿色褪去的原因是________。