题目内容
【题目】氮可以形成多种离子,如N3﹣,NH2﹣,N3﹣,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似
于NH4+,因此有类似于 NH4+的性质.
(1)写出N2H62+在碱性溶液中反应的离子方程式 .
(2)NH2﹣的电子式为 .
(3)N3﹣有 个电子.
(4)写出二种由多个原子组成的含有与N3﹣电子数相同的物质的化学式 .
(5)等电子数的微粒往往具有相似的结构,试预测N3﹣的构型 .
(6)据报道,美国科学家卡尔克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”.迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键.则“N5”分子碎片所带电荷是 .
【答案】(1)N2H62++2OH﹣=N2H4+2H2O;
(2)![]() ;
;
(3)22;
(4)N2O、CO2;
(5)直线型;
(6)一个单位正电荷.
【解析】
试题分析:(1)中N2H62+中N的化合价为+4价,N2H62+是由中性分子
N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中反应的离子方程式为N2H62++2OH﹣=N2H4+2H2O;
(2)NH2﹣的电子式为:![]() ;
;
(3)1个N含有7个电子,故N3﹣有22个电子;
(4)含有22个电子的多原子物质有N2O、CO2、CNO﹣、BeF2、CaH2、C3H4等;
(5)CO2为直线型分子,故可认为N3﹣的构型为直线型;
(6)N5结构是对称的,5个N排成V形,5个N结合后都达到8电子结构,且含有2个N≡N键,满足条件的结构为: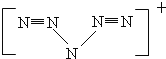 ,故“N5”带一个单位正电荷.
,故“N5”带一个单位正电荷.
(1)中N2H62+中N的化合价为+4价,N2H62+是由中性分子N2H4结合2个质子形成的,故N2H62+相当于二元酸,故在碱性溶液中反应的离子方程式为N2H62++2OH﹣=N2H4+2H2O,故答案为:N2H62++2OH﹣=N2H4+2H2O;
(2)NH2﹣的电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)1个N含有7个电子,故N3﹣有22个电子,故答案为:22;
(4)含有22个电子的多原子物质有N2O、CO2、CNO﹣、BeF2、CaH2、C3H4等,故答案为:N2O、CO2;
(5)CO2为直线型分子,故可认为N3﹣的构型为直线型,故答案为:直线型;
(6)N5结构是对称的,5个N排成V形,5个N结合后都达到8电子结构,且含有2个N≡N键,满足条件的结构为: ,故“N5”带一个单位正电荷,故答案为:一个单位正电荷.
,故“N5”带一个单位正电荷,故答案为:一个单位正电荷.

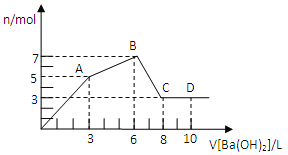
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
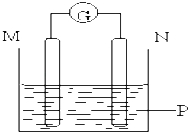
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D