题目内容
【题目】金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。
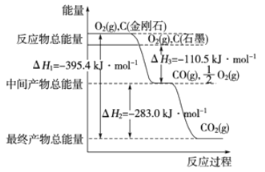
(1)在通常状况下,金刚石和石墨 (填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式 。
(2)12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量 。
(3)已知在常温常压下:
①CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
【答案】(1) 石墨;C(石墨,s)═C(金刚石,s) △H=+1.9 kJmol-1;(2) 252.0kJ;
(3)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1。
【解析】
试题分析:(1)物质含有的能量越低,物质的稳定性就越强。根据图示可知等质量的石墨含有的能量比金刚石低,所以石墨稳定;图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,根据图像分析可知:石墨转化为金刚石需要吸收热量=395.4kJ-393.5kJ=1.9kJ;反应的热化学方程式为C(石墨,s)═C(金刚石,s) △H=+1.9 kJmol-1;(2) 12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若完全生成二氧化碳质量为44g,若生成一氧化碳质量为28g,现在生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图像分析,1mol石墨完全生成CO2放出热量是393.5 kJ,生成CO时放出的热量是110.5 kJ,则生成二氧化碳和一氧化碳的物质的量都是0.5mol时放出热量=393.5 kJmol-1×0.5mol+110.5 kJmol-1×0.5mol=252kJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ;(3) 已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g)+2H2O(g)△H=-359.8kJmol-1;②2CO(g)+O2(g)=2CO2(g)△H=-556.0kJmol-1;③H2O(g)= H2O(l)△H=-44.0kJmol-1,则根据盖斯定律,①+②×1/2+③×2,整理可得:甲醇燃烧热的热化学方程式CH3OH(l)+ 3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJmol-1。