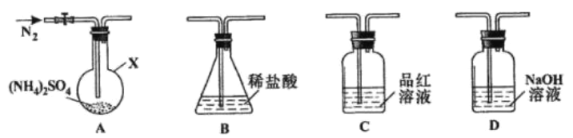
��Ŀ����
����Ŀ����һ���¶��£���3.0molM��2.5molN�����2.0L���ܱ������У�������Ӧ�Ļ�ѧ����ʽΪ��3M(g)+N(g)![]() xP(g)+2Q(g) ��5min��Ӧ�ﵽƽ�⣬�����ڵ�ѹǿ��С����֪Q��ƽ����Ӧ����Ϊ0.10 molL��1min��1������˵��������ǣ� ��
xP(g)+2Q(g) ��5min��Ӧ�ﵽƽ�⣬�����ڵ�ѹǿ��С����֪Q��ƽ����Ӧ����Ϊ0.10 molL��1min��1������˵��������ǣ� ��
A��x��ֵΪ1 B��M��ƽ����Ӧ����Ϊ0.15 molL��1min��1
C��M��ת����Ϊ60% D��ƽ��ʱp��Ũ��Ϊ0.25 molL��1
���𰸡�C
��������
���������A��5min��Ӧ�ﵽƽ�⣬������ѹǿ��С��˵������Ӧ�����������С�ķ�Ӧ������x+2��3+1��x��2��ֻ��Ϊx=1����ȷ��B������֮�ȵ��ڻ�ѧ������֮�ȣ���v��Q��=1.5v��W��=0.15mol/��Lmin������ȷ��C��Q�����ʵ���Ϊ0.1mol/��Lmin����5min��2L=1mol�����ݷ���ʽ��֪�μӷ�Ӧ��Q�����ʵ���Ϊ1mol��3/2=1.5mol����M��ת����Ϊ(1.5mol��3mol)��100%=50%������D������֮�ȵ��ڻ�ѧ������֮�ȣ���v��P��=0.5v��Q��=0.05mol/��Lmin������P��Ũ��Ϊ0.05mol/��Lmin����5min=0.25mol/L����ȷ��

��ϰ��ϵ�д�
�����Ŀ