��Ŀ����
����Ŀ������ʵ��������������ó��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | ��Fe(NO3)2��Һ�е���HI�͵��ۻ����Һ����Һ���� | �����ԣ�Fe2+��I2 |
B | ��3 mL KI��Һ�еμӼ�����ˮ�����ٵμ�1mL������Һ����Һ����ɫ | Cl2�������Ա�I2��ǿ |
C | ��Ag2CO3��ɫ����Һ�еμ�����Na2S��Һ�����ֺ�ɫ���� | Ksp(Ag2S)��Ksp(Ag2CO3) |
D | ����Һ����FeBr3�Ĵ��·�����Ӧ�����õ�������ֱ��ͨ��AgNO3��Һ�У���������ɫ���� | ����Һ�巢��ȡ����Ӧ |
A.AB.BC.CD.D
���𰸡�BC
��������
A������I-�Ļ�ԭ�Դ���Fe2+������Fe(NO3)2��Һ�е���HI�͵��ۻ����Һ����Һ�е�H+��![]() ��I-���Է�����Ӧ����I2����Һ�������ʸ�ʵ�鲻��˵��Fe2+��������ǿ��I2��A����
��I-���Է�����Ӧ����I2����Һ�������ʸ�ʵ�鲻��˵��Fe2+��������ǿ��I2��A����
B����KI��Һ�еμ�������ˮ����Һ�����ɫ��˵����ˮ�е�Cl2����Һ�е�I-������Ӧ����I2���ʸ�ʵ�����˵��Cl2�������Ա�I2��ǿ��B��ȷ��
C����Ag2CO3��ɫ����Һ�еμ�����Na2S��Һ�����ֺ�ɫ�������ú�ɫ����ΪAg2S��˵��������Һ�������ܽ��С��̼������Ӧ�����ܽ�ȸ�С���������ʿ���˵��Ksp(Ag2S)��Ksp(Ag2CO3)��C��ȷ��
D������Һ����FeBr3�Ĵ��·�����Ӧ����HBr���������ڸ÷�ӦΪ���ȷ�Ӧ���õ��������л�����Br2��Br2������������Һ�������ˮ������Ӧ����Br-��Br-��Ag+��Ӧ���ɵ���ɫ��AgBr�������ʲ��ܵ�ƾ�Ƿ��е���ɫ��������ȷ������Һ�巢��ȡ����Ӧ��D����
��ѡBC��

����Ŀ����1���Ҵ���δ����ȼ������ѡ������Һ��ȼ�ϡ�2.0g�Ҵ���ȫȼ������Һ̬ˮ�ų�59.43kJ�����������Ҵ�ȼ�յ��Ȼ�ѧ����ʽ__��
��2����֪�����Ȼ�ѧ����ʽ��
��C(s��ʯī)+O2(g)�TCO2(g) ��H=-393.5kJmol-1
��2H2(g)+O2(g)�T2H2O(l) ��H=-571.6kJmol-1
��2C2H2(g)+5O2(g)�T4CO2(g)+2H2O(l) ��H=-2599kJmol-1
��д��C(s��ʯī)��H2(g)����1mol C2H2(g)���Ȼ�ѧ����ʽ_____��
��3����֪���ֹ��ۼ��ļ����������±���
���ۼ� | N��N | H��H | N��H |
����(kJ/mol) | 946 | 436 | 390.8 |
д���ϳɰ���Ӧ���Ȼ�ѧ����ʽ��____��
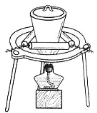
����Ŀ���������ʵ����ѡ���װ�û�����(�г�װ������ȥ)��ȷ���ǣ� ��
A | B | C | D | |
ʵ�� | ��ȡ����������CO2���� | ��CCl4��ȡ��ˮ�е�Br2 | ��ȥCO2��������HCl | ����NaCl������Һ�Ʊ�NaCl���� |
װ�û����� |
|
|
|
|
A.AB.BC.CD.D