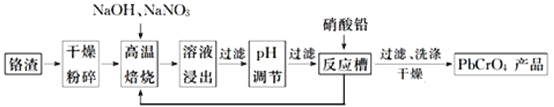
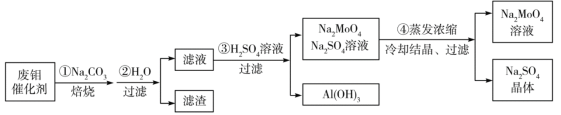
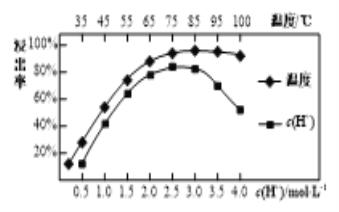
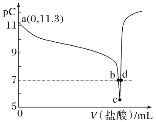
��Ŀ����
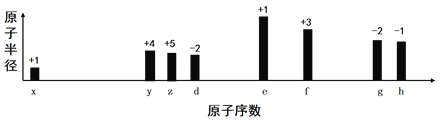
����Ŀ��һ������Ư��(����ͼ)������Ư����ë�ȣ�����W��Y��ZΪ��ͬ���ڲ�ͬ����Ķ�����Ԫ�أ�W��Y��Z������������֮�͵���X��������������W��X��Ӧ�ļ����Ӻ�������Ų���ͬ������������ȷ���ǣ� ��
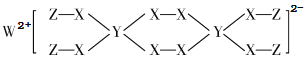
A.��ҵ��ͨ��������ڵ�WX���Ƶ�W
B.W��X��Y��Z��ԭ�Ӱ뾶˳��Ϊ��W > X > Y > Z
C.W��X��ZԪ�ظ����γɵļ����Ӿ����ƻ�ˮ�ĵ���ƽ��
D.��Ư���и�Ԫ�ؾ�����8�����ȶ��ṹ
���𰸡�C
��������
W�ļ�����ΪW2+��˵������ʧȥ�������ӣ�WΪþԪ�أ�X��W�ļ����Ӻ�������Ų���ͬ���ɸ������ӵĽṹ��֪��Xԭ�ӿ����γ��������ۼ�����֪XΪ��Ԫ�أ�Xԭ�ӵ�����������Ϊ6��W��Y��Z������������֮�͵���X����������������Y��Z������������֮��Ϊ6-2=4����W��Y��Zλ�ڲ�ͬ���ڣ���Y��Z��λ�ڵ������ڣ�Zԭ��ֻ���γ�һ�����ۼ�����֪ZΪ��Ԫ�أ�Yԭ�ӵ�����������Ϊ3����YΪ��Ԫ�أ�W��X��Y��Z�ֱ�ΪMg��O��B��H���ݴ˽��
A��WΪMgԪ�أ�XΪOԪ�أ�WXΪMgO��MgO�۵�ϸߣ���ҵ��һ��ͨ����������Ȼ�þ���þ����A����
B�����ݵ��Ӳ���Խ�࣬�뾶Խ��MgԪ�����������Ӳ㣬HԪ��ֻ��һ�����Ӳ㣬��Mg��ԭ�Ӱ뾶���H��ԭ�Ӱ뾶��С��B��O����ͬ���ڣ�ͬ����Ԫ�ش������ң��뾶���μ�С����ԭ�Ӱ뾶B>O����ԭ�Ӱ뾶˳��ΪW>Y>X>Z����B����
C��W��X��ZԪ�ظ����γɵļ����ӷֱ�ΪMg2+��O2-��H+�����֪Mg2+����ˮ�������OH-��ϳ�Mg(OH)2���ٽ�ˮ�ĵ��룬O2-��H+��϶��ٽ�ˮ�ĵ��룬H+������ˮ�ĵ��룬�������Ӿ����ƻ�ˮ�ĵ���ƽ�⣬��C��ȷ��
D����Ư���У�Hԭ��ֻ��һ�����ӣ���ͼ��֪��H��O�γ�һ�Թ��õ��Ӷԣ�HԪ�ز����ܴﵽ8�����ȶ��ṹ������Ԫ�ؾ�����8�����ȶ��ṹ����D����
��ΪC��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�����Ŀ������ʵ��������������ó��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | ��Fe(NO3)2��Һ�е���HI�͵��ۻ����Һ����Һ���� | �����ԣ�Fe2+��I2 |
B | ��3 mL KI��Һ�еμӼ�����ˮ�����ٵμ�1mL������Һ����Һ����ɫ | Cl2�������Ա�I2��ǿ |
C | ��Ag2CO3��ɫ����Һ�еμ�����Na2S��Һ�����ֺ�ɫ���� | Ksp(Ag2S)��Ksp(Ag2CO3) |
D | ����Һ����FeBr3�Ĵ��·�����Ӧ�����õ�������ֱ��ͨ��AgNO3��Һ�У���������ɫ���� | ����Һ�巢��ȡ����Ӧ |
A.AB.BC.CD.D