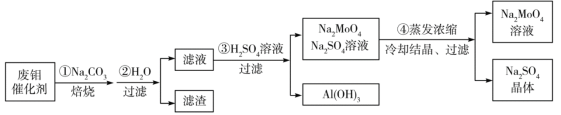
题目内容
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
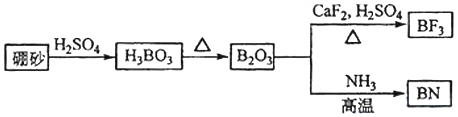
请回答下列问题:
(1)写出B2O3与NH3反应生成BN的化学反应方程式______________
(2)基态N原子的价层电子排布式为________。
(3)B、N、O相比,第一电离能最大的是______,BN中B元素的化合价为_____
(4)写出一个与SO42﹣互为等电子体的微粒__________。
(5)BF3能与NH3反应生成BF3NH3,BF3NH3中BF3与NH3之间通过________(填“离子键”、“配位键”或“氢键”) 结合。
【答案】B2O3+2NH3![]() 2BN+3H2O 2s22p3 N +3 PO43﹣(或CCl4、SiF4) 配位键
2BN+3H2O 2s22p3 N +3 PO43﹣(或CCl4、SiF4) 配位键
【解析】
(1)由工艺流程可知, B2O3与NH3反应生成BN,根据原子守恒可知,还有水生成,反应方程式为B2O3+2NH3![]() 2BN+3H2O;
2BN+3H2O;
答案为:B2O3+2NH3![]() 2BN+3H2O;
2BN+3H2O;
(2)N为7号元素,核外由7个电子,电子排布式为1s22s22p3,基态原子的价层电子排布式为2s22p3。
答案为:2s22p3;
(3)由于氮元素最外层2p轨道半充满,能量低,更稳定,与B、O相比较第一电离能最大;BN中N的第一电离能大于B元素,所以在组成的化合物中N得电子,B失电子,N得三个电子达到稳定结构,为-3价,因此B的化合价为+3价。
答案为:+3;
(4)原子数总数相同、价电子总数相同的粒子,互称为等电子体;SO42﹣5个原子,32个电子,利用位移法,与SO42﹣互为等电子体的微粒有PO43﹣或CCl4或SiF4
答案为:PO43﹣(或CCl4、SiF4)
(5)化合物BF3NH3中,B原子提供空轨道的原子、N原子提供孤电子对,所以B. N原子之间形成配位键;
答案为:配位键。

【题目】根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向Fe(NO3)2溶液中滴入HI和淀粉混合溶液,溶液变蓝 | 氧化性:Fe2+>I2 |
B | 向3 mL KI溶液中滴加几滴氯水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | Cl2的氧化性比I2的强 |
C | 向Ag2CO3白色悬浊液中滴加少量Na2S溶液,出现黑色沉淀 | Ksp(Ag2S)<Ksp(Ag2CO3) |
D | 苯和液溴在FeBr3的催化下发生反应,将得到的气体直接通入AgNO3溶液中,产生淡黄色沉淀 | 苯和液溴发生取代反应 |
A.AB.BC.CD.D