题目内容
13.家用液化气的主要成分之一是丁烷.当10g丁烷完全燃烧并生成二氧化碳和液态水时放出的热量为500kJ.又知1mol液态水汽化时需吸收44kJ热量,则1mol丁烷完全燃烧产生气态水时放出的热量为( )| A. | 2900kJ | B. | 2680kJ | C. | 3120kJ | D. | 2856kJ |
分析 当10g丁烷完全燃烧生成二氧化碳和液态水时放出的热量为500kJ,则1mol丁烷反应放出的热量为:500kJ×$\frac{1mol×58g/mol}{10g}$=2900kJ/mol,故热化学方程式为:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2900kJ/mol,1mol液态水汽化时需要吸收44kJ热量,则:H2O(l)=H2O(g)△H=+44KJ/mol,再根据盖斯定律计算.
解答 解:当10g丁烷完全燃烧生成二氧化碳和液态水时放出的热量为500kJ,则1mol丁烷反应放出的热量为:500kJ×$\frac{1mol×58g/mol}{10g}$=2900kJ/mol,可得热化学方程式为①:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2900kJ/mol,
1mol液态水汽化时需要吸收44kJ热量,可得②:H2O(l)=H2O(g)△H=+44KJ/mol,
根据盖斯定律,①+②×5可得:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(g) 故△H=-2900kJ/mol+5×44kJ/mol=-2680kJ/mol,则1mol丁烷完全燃烧产生气态水时放出的热量为2680kJ,
故选B.
点评 本题考查反应热有关计算,题目难度不大,注意对盖斯定律的理解与运用.

练习册系列答案
相关题目
3.室温下,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) |
4.NA为阿伏伽德罗常数的竖直,下列说法中正确的是( )
| A. | 在密闭容器中加入15mol H2和0.5mol N2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应时失去的电子数为0.1NA | |
| C. | 0.1L的0.1mol•L-1 Na2S溶液中含有的S2-离子数为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
8. 石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
 石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A. | 石墨烯与金刚石互为同位素 | |
| B. | 0.12g石墨烯中含有6.02×1021个碳原子 | |
| C. | 石墨烯中的碳原子间以共价键结合 | |
| D. | 石墨烯是一种新型有机物 |
18.下列有机物完全燃烧,生成二氧化碳和水的物质的量不可能相等的是( )
| A. | 醛类 | B. | 烷烃 | C. | 烯烃 | D. | 酯类 |
10.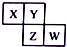 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )| A. | X与Y只形成一种化合物 | |
| B. | 单质Z溶于热的NaOH,生成Na2SO3和另一种盐,若转移电子数为2NA,则参加反应单质Z的质量为64g | |
| C. | XW3与H2O发生非氧化还原反应,只生成两种物质,其中一种为XH3,则另一种物质为HWO | |
| D. | ZY2气体通入BaCI2溶液中有白色沉淀生成 |
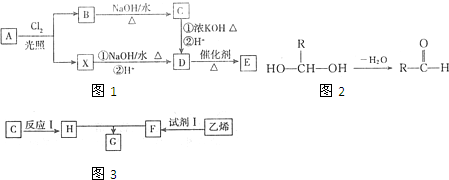
 ,C中官能团的名称是醛基;
,C中官能团的名称是醛基;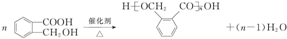 ;
;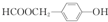 ;
;