题目内容
8. 石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A. | 石墨烯与金刚石互为同位素 | |
| B. | 0.12g石墨烯中含有6.02×1021个碳原子 | |
| C. | 石墨烯中的碳原子间以共价键结合 | |
| D. | 石墨烯是一种新型有机物 |
分析 A.同位素是质子数相同中子数不同的同一元素的不同原子;
B.根据n=$\frac{m}{M}$计算碳原子物质的量,再根据N=nNA计算碳原子数目;
C.碳原子之间形成的化学键是共价键;
D.石墨烯是由石墨剥离而成的,为碳元素的一种单质.
解答 解:A.石墨烯与石墨是碳元素的不同单质,互为同素异形体,故A错误;
B.0.12g石墨烯中含有0.12g碳原子,含有0.01molC原子,含有6.02×1021个碳原子,故B正确;
C.石墨烯中的碳原子之间形成的化学键是共价键,故C正确;
D.石墨烯是由石墨剥离而成的,为碳元素的一种单质,属于无机物,故D错误.
故选BC.
点评 本题考查同位素、同素异形体、共价键和有机物等,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
19.下列说法错误的是( )
| A. | 13C和14C属于同一元素中,它们互为同位素 | |
| B. | 1H和2H是不同的和素,它们的质子数相等 | |
| C. | 16O和18O的电子数相等,并且化学性质相同 | |
| D. | 14C和14N的质量数相等,中子数也相等 |
3.A、B、C、D、E五种短周期元素,其原子序数逐渐增大,元素A的单质是密度最小的气体,元素B的单质存在两种以上同位素异形体,且其中一种是自然界中硬度最大的单质,元素D的最外层电子数是次外层电子数的三倍,B、C、D、E四种元素均能与A形成等电子数的四种分子,且化合物中各原子的个数比如表
下列说法正确的是( )
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 原子个数比 | B:A=1:3 | C:A=1:2 | D:A=1:1 | E:A=1:1 |
| A. | 元素E在元素周期表中的位置为第三周期、VIIA族 | |
| B. | 原子半径:A<B<C<D | |
| C. | 甲和丙分子均只含极性键 | |
| D. | A、B、C、D四种元素中的三种能形成多种与甲分子等电子数的化合物 |
13.家用液化气的主要成分之一是丁烷.当10g丁烷完全燃烧并生成二氧化碳和液态水时放出的热量为500kJ.又知1mol液态水汽化时需吸收44kJ热量,则1mol丁烷完全燃烧产生气态水时放出的热量为( )
| A. | 2900kJ | B. | 2680kJ | C. | 3120kJ | D. | 2856kJ |
20.将1mol H2S和a mol O2置于一密闭容器中,在120℃下进行反应,测得产物中既有S又有SO2,则此时容器内气体的物质的量之和为( )
| A. | (a-0.5)mol | B. | (a+0.5)mol | C. | (1+0.5a)mol | D. | (1-0.5a)mol |
6.下列有关叙述正确的是( )
| A. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| B. | 实验室点燃H2前,应先检验气体纯度 | |
| C. | 氯水与亚硫酸钠溶液的混合液,漂白性更强 | |
| D. | 不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,然后涂上烧碱溶液 |
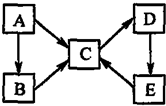 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系: