题目内容
10.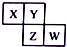 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )| A. | X与Y只形成一种化合物 | |
| B. | 单质Z溶于热的NaOH,生成Na2SO3和另一种盐,若转移电子数为2NA,则参加反应单质Z的质量为64g | |
| C. | XW3与H2O发生非氧化还原反应,只生成两种物质,其中一种为XH3,则另一种物质为HWO | |
| D. | ZY2气体通入BaCI2溶液中有白色沉淀生成 |
分析 由X、Y、Z、W均为短周期元素的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是K层电子数的3倍,则Y为O元素,可推知X为N元素、Z为S元素、W为C.
A.N元素有+1、+2、+3、+4、+5等化合价,可以形成多种氧化物;
B.单质硫溶于热的NaOH,生成Na2SO3和另一种盐,由电子转移守恒可知另一种盐为Na2S,根据电子转移守恒计算Na2SO3、Na2S的物质的量,根据S原子守恒计算硫的物质的量,再根据m=nM计算硫的质量;
C.NCl3与H2O发生非氧化还原反应,只生成两种物质,其中一种为NH3,发生水解反应,另外物质为HClO;
D.SO2不能与BaCl2溶液反应.
解答 解:由X、Y、Z、W均为短周期元素的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是K层电子数的3倍,则Y为O元素,可推知X为N元素、Z为S元素、W为C.
A.N元素与氧元素可以形成N2O、NO、N2O3、NO2、N2O4、N2O5,故A错误;
B.单质硫溶于热的NaOH,生成Na2SO3和另一种盐,由电子转移守恒可知另一种盐为Na2S,若转移电子数为2NA,即为2mol,根据电子转移守恒生成Na2SO3的物质的量为$\frac{2mol}{4}$=0.5mol,Na2S的物质的量为$\frac{2mol}{2}$=1mol,根据S原子守恒可知参加反应硫的质量为(0.5mol+1mol)×32g/mol=48g,故B错误;
C.NCl3与H2O发生非氧化还原反应,只生成两种物质,其中一种为NH3,发生水解反应,另外物质为HClO,故C正确;
D.SO2不能与BaCl2溶液反应,故D错误,
故选C.
点评 本题考查位置结构性质的应用,Z为推断的突破口,B中注意利用电子转移守恒解得,难度不大.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | 金属钠投入水中的离子方程式;Na+2H2O=Na++2OH-+O2↑ | |
| B. | 常温下,0.1mol/L氯化铵溶液pH=5的原因:NH4++H2O?NH3•H2O+H+ | |
| C. | 用惰性电极电解饱和食盐水的阳极反应式:2Cl--2e-=Cl2↑ | |
| D. | 乙醛与新制的氢氧化铜悬浊液反应的离子方程式:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
| A. | 2900kJ | B. | 2680kJ | C. | 3120kJ | D. | 2856kJ |
| A. | 氯化铁溶液中滴入KSCN后溶液变为血红色 | |
| B. | 将钠投入水中所得溶液中含有Na+,OH-和H2O分子 | |
| C. | 氯气溶解于水得到的氯水中既含有Cl2,H2O分子,又含有H+,Cl2,HClO等微粒 | |
| D. | 向硝酸银溶液中加入少量的铜粉,充分反应后往上层清夜中滴加KBr溶液呈浅黄色 |
| A. | H2、D2、T2三者互为同素异形体 | |
| B. | NH4Cl的电子式为: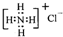 | |
| C. | 放射性同位素${\;}_{67}^{166}$Ho的原子核内的中子数与核外电子数之差是32 | |
| D. | 聚丙烯的结构简式为: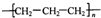 |
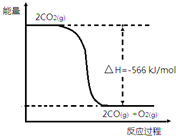 已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
( )
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 如图可表示①反应过程中的能量变化 | |
| C. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 由②可知,反应生成Na2CO3固体106g,放出热量226kJ•mol-1 |
| A. | K+、Ca2+、Cl-、SO42- | B. | Na+、Fe3+、NO3-、SCN- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | Fe2+、H+、NO3-、Cl- |