题目内容
3.室温下,下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) |
分析 A、醋酸是弱酸存在电离平衡,水的电离平衡;
B、碳酸氢钠溶液中碳酸氢根离子水解大于电离;
C、硫酸铵溶液中铵根离子水解,溶液呈酸性;
D、依据溶液中的质子守恒分析判断,水电离出的氢离子和氢氧根离子相同.
解答 解:A、醋酸是弱酸存在电离平衡,水的电离平衡,溶液中氢离子浓度大于醋酸根离子浓度,c(H+)>c(CH3COO-)>c(OH-),故A错误;
B、碳酸氢钠溶液中碳酸氢根离子水解大于电离,c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C、硫酸铵溶液中铵根离子水解,溶液呈酸性,铵根离子浓度小于硫酸根离子浓度2倍,溶液中离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故C正确;
D、依据溶液中的质子守恒分析判断,水电离出的氢离子和氢氧根离子相同,溶液中存在质子守恒c(H+)=c(NH3•H2O)+c(OH-),故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度的大小比较,盐类水解的分析判断,注意溶液中电离和水解的程度比较方法,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13. X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| B. | 只由这四种元素不能组成有机化合物 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
14.化学学科需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | CO2分子比例模型: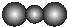 | B. | NH4I的电子式: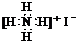 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | K+最外层电子排布式:4S24P6 |
11.一定温度下,将浓度为0.1mol•L-1的Na2CO3溶液加水不断稀释,下列各值始终增大的是( )
| A. | c(H+) | B. | c(HCO${\;}_{3}^{-}$) | ||
| C. | c(H+)•c(OH-) | D. | $\frac{c(O{H}^{-})•c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$ |
8. 新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )
新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )
 新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )
新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )| A. | 该储氢装置的电流效率η=64.3% | |
| B. | D电极室发生的所有的电极反应为:C4H6+6H++6e-═C6H12 | |
| C. | B电极为电源的负极 | |
| D. | H+由D电极室移向E电极室 |
15.X、Y、Z为短周期元素,X元素原子的最外层电子数是1,Y元素的最高正价和最低负价代数和为0,Z元素位于周期表中第16纵列,则由这三种元素组成的化合物的化学式不可能是( )
| A. | XYZ | B. | X2YZ | C. | X2Y2Z4 | D. | X2YZ3 |
12.以下反应式不正确的是( )
| A. | 金属钠投入水中的离子方程式;Na+2H2O=Na++2OH-+O2↑ | |
| B. | 常温下,0.1mol/L氯化铵溶液pH=5的原因:NH4++H2O?NH3•H2O+H+ | |
| C. | 用惰性电极电解饱和食盐水的阳极反应式:2Cl--2e-=Cl2↑ | |
| D. | 乙醛与新制的氢氧化铜悬浊液反应的离子方程式:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
13.家用液化气的主要成分之一是丁烷.当10g丁烷完全燃烧并生成二氧化碳和液态水时放出的热量为500kJ.又知1mol液态水汽化时需吸收44kJ热量,则1mol丁烷完全燃烧产生气态水时放出的热量为( )
| A. | 2900kJ | B. | 2680kJ | C. | 3120kJ | D. | 2856kJ |
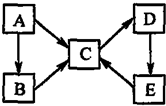 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系: