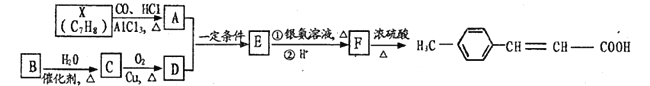
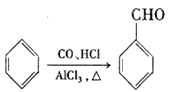
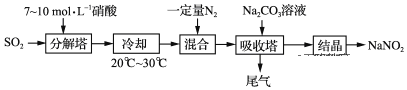
题目内容
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
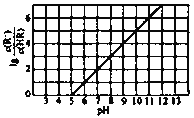
(1)已知:![]()
![]()
![]()
![]()
![]()
![]()
则反应![]()
![]() __________。
__________。
(2)科学家研究出了一种高效催化剂,可以将![]() 和
和![]() 发生反应生成
发生反应生成![]() (g)和
(g)和![]() (g)。在T℃下,向某恒容密闭容器中通入a mol/L
(g)。在T℃下,向某恒容密闭容器中通入a mol/L![]() 、b mol/L
、b mol/L![]() ,使其发生上述反应,测得
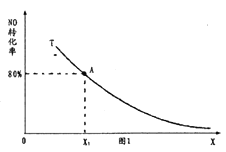
,使其发生上述反应,测得![]() 的平衡转化率与投料比X(表示a、b两者的比值)的关系如图1中曲线所示。若
的平衡转化率与投料比X(表示a、b两者的比值)的关系如图1中曲线所示。若![]() 、
、![]() ,反应开始到达到平衡所用时间是2min,则反应发生2min内
,反应开始到达到平衡所用时间是2min,则反应发生2min内![]() 的平均反应速率v(
的平均反应速率v(![]() )=________,平衡态A点的平衡常数K=________。
)=________,平衡态A点的平衡常数K=________。
(3)柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。Urea-SCR的工作原理为:尿素[![]() ]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解产生
]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解产生![]() ,生成的
,生成的![]() 与尾气混合后,加入适合的催化剂,使氮氧化物得以处理。图2为在不同投料比[
与尾气混合后,加入适合的催化剂,使氮氧化物得以处理。图2为在不同投料比[![]() ]时
]时![]() 转化效率随温度变化的曲线。
转化效率随温度变化的曲线。
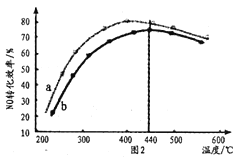
①尿素与![]() 物质的量比a_____b(填“>”、“=”或“<”)。
物质的量比a_____b(填“>”、“=”或“<”)。
②由图可知,下列说法错误的是____
A.400℃以下,随着温度升高,尿素水解释放氨气的速率加快,![]() 转化效率升高
转化效率升高
B.400℃以下,温度升高,反应活化能降低,导致化学反应速率加快
C.440℃以上,温度过高,可能使催化剂活性降低,导致![]() 转化效率下降
转化效率下降
【答案】-746.5kJ·mol-1 0.4mol/(L·min) 80.0 > B
【解析】
(1)利用盖斯定律计算△H;
(2)根据三段式计算即可;
(3)①尿素分解生成氨气,氨气的浓度越大,越有利于NO的转化;
②温度过高,NO转化效率下降,NO的浓度反而升高,与反应4NH3+5O2![]() 4NO+6H2O有关。
4NO+6H2O有关。
(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJmol-1
②2C(s)+O2(g)=2CO(g)△H2=-221.0 kJmol-1
③N2(g)+O2(g)=2NO(g)△H3=+180.5 kJmol-1
利用盖斯定律,将①×2-②-③可得2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=2×(-393.5kJmol-1)-(-221.0 kJmol-1)-(+180.5 kJmol-1)=-746.5 kJmol-1,则热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJmol-1;
(2)A点NO的转化率为80%,X1=1.0、a=2,此时
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度(mol/L)2.0 2.0 0 0
变化浓度(mol/L)1.6 1.6 0.8 1.6
平衡浓度(mol/L)0.4 0.4 0.8 1.6
反应开始到达到平衡所用时间是2min,则反应发生2min内![]() 的平均反应速率v(
的平均反应速率v(![]() )=
)=![]() =0.4mol/(L·min),平衡态A点的平衡常数K=
=0.4mol/(L·min),平衡态A点的平衡常数K=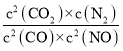 =
=![]() =80.0;
=80.0;
(3)①尿素分解生成氨气,氨气的浓度越大,越有利于NO的转化,则尿素与NO物质的量比a大于b;
②A.由图可知,在400℃以下,随着温度升高,尿素水解释放氨气的速率加快,![]() 转化效率升高,故A正确;
转化效率升高,故A正确;
B.由图可知,400℃以下,升高反应的温度,提供能量,则活化分子百分数增加,有效碰撞的几率提高,反应率增大,反应活化能不变,故B错误;
C.由图可知,440℃以上,温度过高,催化剂活性降低,并导致![]() 转化效率下降,故C正确;
转化效率下降,故C正确;
故答案为B。