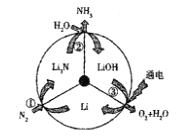
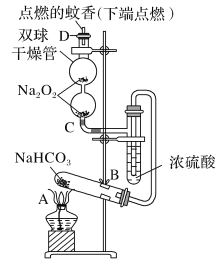
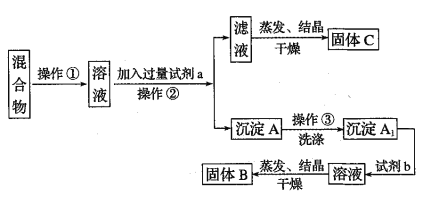
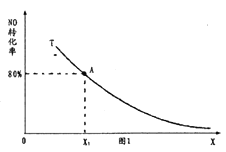
题目内容
【题目】以下说法正确的是
A.12.0gNaHSO4溶于1L水中,溶液中氢离子的浓度为0.1mol/L
B.25℃时气体的摩尔体积大于22.4L/mol
C.阿伏加德罗常数近似为6.02×1023
D.氦气的摩尔质量是4g/mol
【答案】D
【解析】
A. NaHSO4为强电解质,在溶液中完全电离,电离方程式为:NaHSO4=Na++H++ SO42-,12.0gNaHSO4的物质的量为![]() ,溶于1L水中,所得溶液的体积不是1L,则溶液中氢离子浓度不是0.1mol/L,故A错误;
,溶于1L水中,所得溶液的体积不是1L,则溶液中氢离子浓度不是0.1mol/L,故A错误;
B. 标况即0℃、101 KP时,气体摩尔体积为22.4L/mol,25℃时,因压强不定,所以此时气体的摩尔体积不确定,故B错误;
C. 阿伏伽德罗常数的单位为mol-1,即阿伏伽德罗常数近似为6.02×1023 mol-1,故C错误;
D. 氦原子的相对原子质量为4,而氦气为单原子分子,分子摩尔质量在数值上等于该物质的相对分子质量,故氦气的摩尔质量为4g/mol,故D正确。
答案选D。

 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】根据下列实验操作和现象能得出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A |
| 溶液红色褪去 |
|
B | 向1mL 2mol/L | 先生成白色沉淀,后生成红褐色沉淀 |
|
C | 将 | 溶液变为红色 | 样品已部分或全部变质 |
D | 无水乙醇中加入浓硫酸,加热,产生的气体Y通入酸性 | 溶液紫色褪去 | 气体Y中含有乙烯 |
A. AB. BC. CD. D
【题目】钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1 mol/L的下列五种钠盐溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述几种钠盐的阴离子,结合氢离子能力最强的是______(填离子符号),根据表中数据,将浓度均为0.01mol/L的下列四种溶液分别稀释100倍,pH变化最大的是______.(填字母)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)已知几种离子开始沉淀时溶液的pH如下表所示:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含有相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,________(填离子符号)先沉淀;Ksp[Fe(OH)2]______(填“>”“=”或“<”)Ksp[Mg(OH)2];要使0.2 mol/L的硫酸铜溶液中铜离子沉淀较为完全(使铜离子的浓度降至原来的千分之一),则应向溶液中加入氢氧化钠溶液使溶液pH=_______。{Cu(OH)2的Ksp=2×10-20。}