题目内容
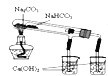
【题目】将8.7 g MnO2与足量浓盐酸混合加热,反应生成氯气的体积(标准状况)是多少L?;被氧化的HCl的质量是多少g?。
【答案】2.24L 7.3g
【解析】
根据化学反应方程式MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O计算。
MnCl2+Cl2↑+2H2O计算。
因为浓盐酸足量,故产生氯气的体积和被氧化的HCl的质量都是由8.7gMnO2决定的。根据反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中氯元素化合价的变化可知,4molHCl中只有2molHCl被氧化为Cl2。8.7gMnO2的物质的量=
MnCl2+Cl2↑+2H2O中氯元素化合价的变化可知,4molHCl中只有2molHCl被氧化为Cl2。8.7gMnO2的物质的量=![]() =0.1mol,设反应生成氯气的体积为V,被氧化的HCl的质量为x。则有:
=0.1mol,设反应生成氯气的体积为V,被氧化的HCl的质量为x。则有:
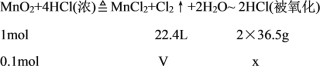
列比例式:![]() =
=![]() =
=![]() ,解得V=2.24L,x=7.3g。即反应生成氯气在标准状况下的体积为2.24L,被氧化的HCl的质量是7.3g。
,解得V=2.24L,x=7.3g。即反应生成氯气在标准状况下的体积为2.24L,被氧化的HCl的质量是7.3g。

练习册系列答案
相关题目