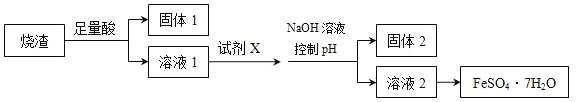
题目内容
【题目】某化学实验小组用如图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。
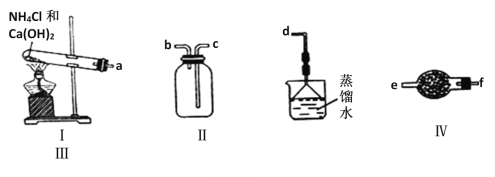
回答下列问题:
(1)开始实验之前要进行的操作是________________________________
(2)写出利用装置I制取氨气的化学方程式_____________________________。
(3)按照a、f、e、b、c、d的顺序将仪器连接,装置Ⅲ中倒置漏斗的作用是____________,装置IV中仪器的名称为_____________,盛装的试剂为_____________。
(4)向NH3的水溶液中滴加1~2滴酚酞溶液,溶液颜色由无色变________色,说明溶液显____性,写出其电离方程式______。
【答案】检验装置气密性 2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑ 防止倒吸 球形干燥管 碱石灰 红 碱性 NH3· H2O
CaCl2+2H2O+2NH3↑ 防止倒吸 球形干燥管 碱石灰 红 碱性 NH3· H2O![]() NH4++OH-
NH4++OH-
【解析】
(1)任何制取气体装置在使用之前都要检查装置的气密性;
(2)装置I中的反应方程式为:2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑,注意加热条件要标注;
CaCl2+2H2O+2NH3↑,注意加热条件要标注;
(3)装置Ⅲ中倒扣的漏斗是用于防止液体倒吸回试管的受热部位,引起试管的破裂;注意漏斗的下沿刚好浸入液面;装置IV是球形干燥管,盛装的固体试剂是碱石灰,注意其连接方式是大口进,小口出;
(4)一水合氨的电离使溶液显碱性:NH3·H2O![]() NH4++OH-,加入酚酞,溶液变红色。
NH4++OH-,加入酚酞,溶液变红色。

【题目】根据要求回答下列有关问题。
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H2=-28.0kJ/mol
2Fe(s)+3CO2(g)△H2=-28.0kJ/mol
③C(石墨)+CO2(g)=2CO(g)△H3=akJ/mol
则a=_______kJ/mol。
(2)工业合成氨时,合成塔中每产生1molNH3放出46.1kJ的热量。
某小组研究在500℃下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
a | 1 | 4 | 0 | t1min | 放出热量:27.66kJ |
b | 2 | 8 | 0 | t2min | 放出热量:Q |
①容器a中,0~t1时间的平均反应速率为v(H2)=_______。
②容器b中反应达平衡状态时,Q_______55.32kJ;平衡时,容器中H2的转化率:a_______b(填“>”或“<”或“=”)。
(3)以氨为原料,合成尿素的反应原理为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。
CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。
为研究平衡时CO2的转化率与反应物投料比[![]() ]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
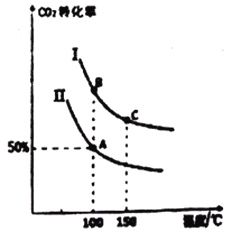
①a_______0(填“>”或“<”)。
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.5,在100℃条件下发生反应,达平衡至
③A点平衡常数与B点平衡常数间的关系:KA_______KB;
B点平衡常数与C点平衡常数间的关系,KB_______KC(填“>”或“<”或“=”)