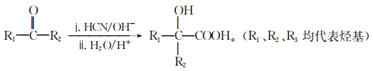题目内容
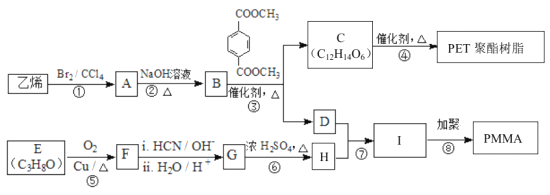
【题目】用如图所示各装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。

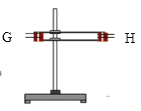
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A接G,H接C,D接_______,_______接C,D接B ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中_____________________________,丙中_____________________________;
(3)丁中酸性KMnO4溶液的作用是___________________________________________;
(4)写出甲中反应的化学方程式_________________________________________ 。
(5)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的括号中:
A.脱水性 B.酸性 C.强氧化性 D.吸水性
Ⅰ.在化学实验中,浓硫酸可做SO2、CO2等气体的干燥剂。 (_______)
Ⅱ.Na2CO3与H2SO4反应,可生成Na2SO4和CO2。 (_______)
Ⅲ.向滤纸上滴加浓H2SO4 ,滤纸变黑。 (_______)
Ⅳ.在冷浓H2SO4中放入铁片没明显现象 (_______)
【答案】F E 澄清石灰水变浑浊 品红不退色 除去气体中的SO2 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O D B A C
CO2↑+2SO2↑+2H2O D B A C
【解析】
浓硫酸与木炭粉反应C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,实验目的是验证反应产生的各种产物。水蒸气通常用无水硫酸铜检验,SO2用品红溶液检验,用澄清石灰水检验CO2。因为SO2也能使澄清石灰水变浑浊:Ca(OH)2+SO2=CaSO3↓+H2O,所以在检验CO2前必须除尽SO2,并实验证明SO2已经除尽,以此连接实验装置。浓硫酸具有强酸性,能够制取碳酸产生CO2,浓硫酸的强氧化性使铁钝化,浓硫酸的吸水性使浓硫酸可作某些气体的干燥剂,浓硫酸能够将纤维素中的氢、氧元素按水的比例脱下,生成水而使纤维素炭化。由此分析。
CO2↑+2SO2↑+2H2O,实验目的是验证反应产生的各种产物。水蒸气通常用无水硫酸铜检验,SO2用品红溶液检验,用澄清石灰水检验CO2。因为SO2也能使澄清石灰水变浑浊:Ca(OH)2+SO2=CaSO3↓+H2O,所以在检验CO2前必须除尽SO2,并实验证明SO2已经除尽,以此连接实验装置。浓硫酸具有强酸性,能够制取碳酸产生CO2,浓硫酸的强氧化性使铁钝化,浓硫酸的吸水性使浓硫酸可作某些气体的干燥剂,浓硫酸能够将纤维素中的氢、氧元素按水的比例脱下,生成水而使纤维素炭化。由此分析。
(1)本实验的目的是验证浓硫酸与木炭粉反应产生的水蒸气、二氧化硫、二氧化碳。应该先用无水硫酸铜验证水蒸气,再用品红溶液检验SO2。因为SO2也能使澄清石灰水变浑浊,在检验CO2前必须除去气体中的SO2。酸性KMnO4溶液能充分吸收SO2,再用品红溶液证明SO2已除尽,最后用澄清石灰水验证CO2。所以连接上述装置的正确顺序是A接G,H接C,D接F,E接C,D接B。
(2)只有丙中品红不退色,才能确信SO2已经除尽;能够使澄清石灰水变浑浊的只有CO2,所以表明已检验出CO2的实验现象是乙中澄清石灰水变浑浊,丙中品红不退色。
(3)KMnO4酸性溶液能够充分吸收SO2气体:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,所以丁中酸性KMnO4溶液的作用是除去气体中的SO2。
(4)加热条件下浓硫酸氧化木炭粉的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(5)I、浓硫酸具有吸收性,能干燥SO2、CO2等气体,答案选D;II、硫酸属于强酸,强酸制弱酸,答案选B。III、浓硫酸具有脱水性,滤纸的主要成分是纤维素[(C6H10O5)n],(C6H10O5)n![]() 6nC+5nH2O,答案选A。IV、浓硫酸具有强氧化性,常温下浓硫酸能使铁的表面形成一层致密氧化物薄膜阻止浓硫酸与铁继续反应(称为钝化),答案选C。
6nC+5nH2O,答案选A。IV、浓硫酸具有强氧化性,常温下浓硫酸能使铁的表面形成一层致密氧化物薄膜阻止浓硫酸与铁继续反应(称为钝化),答案选C。

【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | c | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)表中b_____c(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为_____mol/L,0~20s内N2O4的平均反应速率为_________.
(3)该反应在80℃时该反应的平衡常数K值为_______(保留2位小数).
【题目】将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的物质的量与加入X的物质的量关系如图所示,符合图示情况的是( )
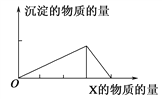
A | B | C | D | |
X | NaOH | HCl | CO2 | AlCl3 |
Y | AlCl3 | NaAlO2 | Ca(OH)2 | NaOH |
A. A B. B C. C D. D
【题目】下列物质与水反应生成强碱的是( )
A. NH3 B. Na2O C. CO2 D. NO2
【答案】B
【解析】
A. NH3溶于水生成一水合氨,属于弱碱,A错误;B. Na2O溶于水生成氢氧化钠,是强碱,B正确;C. CO2溶于水生成碳酸,属于弱酸,C错误;D. NO2溶于水生成硝酸和NO,硝酸是强酸,D错误,答案选B。
【题型】单选题
【结束】
19
【题目】利用下列装置可以完成的实验组合是
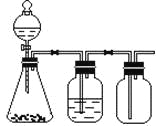
选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D