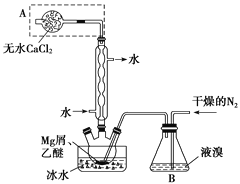
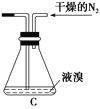
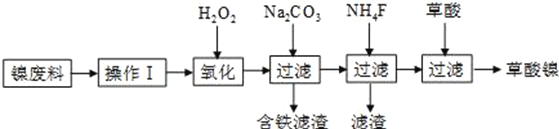
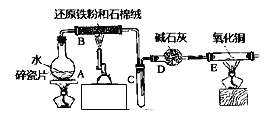
题目内容
【题目】水中的溶解氧是水生生物生存不可缺少的条件,某课外小组采用碘量法测定学校周边河水中的溶解氧,实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2![]() +I2=2I+
+I2=2I+![]() )。
)。
回答下列问题:
(1)氧的固定”中发生反应的化学方程式为_________________________________。
(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、胶头滴管、试剂瓶和_________________________,配制溶液定容时俯视会导致Na2S2O3溶液的浓度__________,(填“偏高”或“偏低”)蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除________________及二氧化碳。
(3)取100.00 mL水样经固氧、酸化后,用0.5 mol·L1Na2S2O3溶液滴定,以_________作指示剂,如何判断该反应到达终点_________________________________________________;若反应中消耗Na2S2O3溶液的体积为10 mL,则水样中溶解氧的含量为_________mg·L1。
(4)上述滴定完成时,若滴定前平视,滴定后仰视会导致测量结果___________。(填“偏高”或“偏低”)
【答案】![]() 容量瓶和玻璃棒偏高氧气淀粉溶液当滴加最后一滴Na2S2O3溶液时蓝色刚好褪去,且半分钟内不变色400偏高
容量瓶和玻璃棒偏高氧气淀粉溶液当滴加最后一滴Na2S2O3溶液时蓝色刚好褪去,且半分钟内不变色400偏高
【解析】
(1)由题述信息可知“氧的固定”中发生反应的化学方程式为![]() ;(2)配制一定物质的浓度的溶液所需的玻璃仪器有烧杯、胶头滴管、试剂瓶、玻璃棒、容量瓶等,故答案为容量瓶和玻璃棒;定容时俯视会造成溶液的体积偏大,所配溶液的浓度偏高,故答案为偏高;(3)水样经固氧、酸化后,滴入淀粉,溶液呈蓝色,用0.5 mol·L1Na2S2O3溶液滴定至终点时溶液的蓝色恰好完全褪去;根据关系式O2~2MnO(OH)2~2I2~4Na2S2O3,可知水样中溶解氧含量为[(0.5×10×10-3)÷4×32×103]÷0.1=400(mg·L1),故答案为:淀粉、当滴加最后一滴Na2S2O3溶液时蓝色刚好褪去,且半分钟内不变色、400;(4)若滴定前平视,滴定后仰视会造成消耗Na2S2O3溶液的体积偏大,从而导致测量结果偏高,故答案为偏高。
;(2)配制一定物质的浓度的溶液所需的玻璃仪器有烧杯、胶头滴管、试剂瓶、玻璃棒、容量瓶等,故答案为容量瓶和玻璃棒;定容时俯视会造成溶液的体积偏大,所配溶液的浓度偏高,故答案为偏高;(3)水样经固氧、酸化后,滴入淀粉,溶液呈蓝色,用0.5 mol·L1Na2S2O3溶液滴定至终点时溶液的蓝色恰好完全褪去;根据关系式O2~2MnO(OH)2~2I2~4Na2S2O3,可知水样中溶解氧含量为[(0.5×10×10-3)÷4×32×103]÷0.1=400(mg·L1),故答案为:淀粉、当滴加最后一滴Na2S2O3溶液时蓝色刚好褪去,且半分钟内不变色、400;(4)若滴定前平视,滴定后仰视会造成消耗Na2S2O3溶液的体积偏大,从而导致测量结果偏高,故答案为偏高。

【题目】根据要求回答下列有关问题。
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H2=-28.0kJ/mol
2Fe(s)+3CO2(g)△H2=-28.0kJ/mol
③C(石墨)+CO2(g)=2CO(g)△H3=akJ/mol
则a=_______kJ/mol。
(2)工业合成氨时,合成塔中每产生1molNH3放出46.1kJ的热量。
某小组研究在500℃下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
a | 1 | 4 | 0 | t1min | 放出热量:27.66kJ |
b | 2 | 8 | 0 | t2min | 放出热量:Q |
①容器a中,0~t1时间的平均反应速率为v(H2)=_______。
②容器b中反应达平衡状态时,Q_______55.32kJ;平衡时,容器中H2的转化率:a_______b(填“>”或“<”或“=”)。
(3)以氨为原料,合成尿素的反应原理为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。
CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。
为研究平衡时CO2的转化率与反应物投料比[![]() ]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
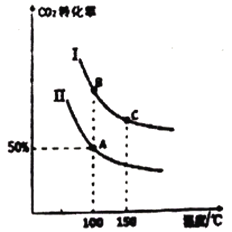
①a_______0(填“>”或“<”)。
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.5,在100℃条件下发生反应,达平衡至
③A点平衡常数与B点平衡常数间的关系:KA_______KB;
B点平衡常数与C点平衡常数间的关系,KB_______KC(填“>”或“<”或“=”)