题目内容
【题目】在恒温、容积为2L的密闭容器中通入1mol X和2mol Y,发生反应:X(s)+2Y(g) ![]() 3Z(g) ΔH=-a kJ/mol (a>0),5min末测得Z的物质的量为1.2mol。则下列说法正确的是
3Z(g) ΔH=-a kJ/mol (a>0),5min末测得Z的物质的量为1.2mol。则下列说法正确的是
A. 若反应体系中气体的压强保持不变,说明反应达到了平衡状态
B. 0~5min,X的平均反应速率为0.04mol ·L-1·min-1
C. 达到平衡时,反应放出的热量为a kJ
D. 达到平衡时,Y和Z的浓度之比一定为2∶3
【答案】A
【解析】
A.正反应为气体物质的量增大的反应,恒温恒容条件下,随反应进行压强增大,反应体系中气体的压强保持不变,说明反应达到了平衡状态,故A正确;
B.X为固体,不能用单位时间内浓度变化量表示反应速率,故B错误;
C.该反应属于可逆反应,X、Y不能完全转化为生成物,达到平衡状态时X消耗的物质的量小于1mol,所以放出的热量小于a kJ,故C错误;
D.当体系达平衡状态时,Y、Z 的浓度之比可能为 2∶3,也可能不是2∶3,与各物质的初始浓度及转化率等有关,故D错误;
故选A。

【题目】某班几个兴趣小组做了以下实验。
甲组:两同学利用下列试剂:铁粉、0.1mol/L FeCl3溶液、0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+ 的性质,设计实验方案进行实验,完成下列表格。
探究内容 | 实验方案 | 实验现象 | 写出离子方程式 |
①探究Fe2+具有还原性 | 取少FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量________。 | 溶液先不变红,后变为血红色。 | Fe2+发生的反应: _____________ |
②探究Fe3+具有氧化性 | 取少量FeCl3溶液,加入足 量______后,振荡,静置,再往溶液中加入少量KSCN溶液。 | 溶液不变为血红色。 | Fe3+发生的反应:________ |
乙组:两同学利用下图所示的装置进行铁与水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
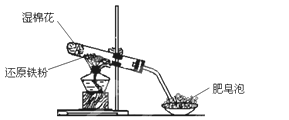
请回答下列问题。
(1)硬质试管中发生反应的化学方程式为_______________。
(2)欲确定反应后硬质试管中固体物质的成分,实验过程如下:
①待硬质试管冷却后,取少许其中的固体物质溶于足量稀硫酸得溶液B;
②取少量溶液B于试管a中,滴加KSCN溶液,溶液没有变红色,则溶液B中的阳离子有_________________,硬质试管中固体物质的成分是_________________。
(3)另取少量溶液B,使其与NaOH溶液反应(按图所示),在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。请写出与上述现象中白色沉淀转化红褐色沉淀的化学方程式________________。
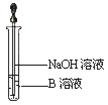
(4)一段时间后,发现a中未变红的溶液变成红色,原因是 _______________