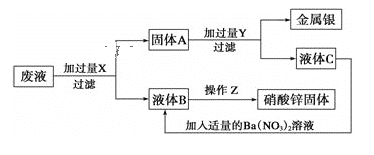
题目内容
【题目】Ⅰ.实验室要配制100 mL物质的量浓度为0.1mol/L的KMnO4溶液,回答问题:
(1)要配制上述溶液,所需仪器除天平、药匙、烧杯、玻璃棒、胶头滴管外,还需要___;
(2)根据计算,所需KMnO4固体的质量为___g(取小数点后两位);
(3)下列操作会导致所配溶液浓度偏低的是___(填选项代号)。
A.定容时加水超过刻度线,用胶头滴管吸出一些
B.定容时仰视刻度线
C.转移溶液后,没有洗涤烧杯内壁
D.配制前容量瓶内壁仍残留有蒸馏水
E.转移溶液时部分溶液溅出
Ⅱ.KMnO4是一种强氧化剂, 加酸酸化能够提高其氧化性,通常用硫酸酸化而不能用盐酸酸化,原因是KMnO4可以和盐酸发生反应。
(4)用双线桥法分析反应:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O___。该反应中,还原产物是___。
(5)若转移的电子数为0.4mol,则产生标况下气体体积为___。
【答案】100mL容量瓶 1.58g ABCE 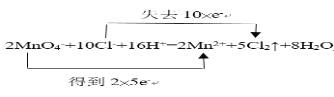 Mn2+ 4.48L
Mn2+ 4.48L
【解析】
I.配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,首先计算所需溶质的质量或体积,一般固体用天平称质量,液体用量筒量取体积,把溶质倒入烧杯进行溶解,冷却后转移到容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至液面和刻度线相平,然后摇匀,装瓶,贴标签,即完成溶液的配制;
II.根据氧化还原反应规律进行该反应中10e----5Cl2关系进行计算。
(1)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般天平称量固体,把高锰酸钾倒入烧杯进行溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、100mL容量瓶,所以还需要100mL容量瓶,
答案为:100mL容量瓶;
(2)![]() 的物质的量为
的物质的量为![]() ,
,![]() 的质量为
的质量为![]() ,
,
故答案为:1.58g;
(3)A.定容时加水超过刻度线,用胶头滴管吸出一些,导致溶质的物质的量偏小,配制的溶液浓度偏低;
B.定容时仰视,导致溶液的体积偏大,所以配制溶液的浓度偏低;
C.转移溶液后,没有洗涤烧杯内壁,导致溶质的物质的量偏小,配制的溶液浓度偏低;
D.配制前容量瓶内壁仍残留有蒸馏水,对溶质的物质的量和溶液的体积无影响,所以配制的溶液浓度无影响;
E.转移溶液时部分溶液溅出容量瓶外,导致溶质的物质的量偏小,配制的溶液浓度偏低;
故答案为:ABCE;
(4)![]() 该反应中锰元素化合价降低得电子,氯元素化合价升高失电子,故双线桥为:
该反应中锰元素化合价降低得电子,氯元素化合价升高失电子,故双线桥为: ,还原产物是化合价降低后得到的产物,即
,还原产物是化合价降低后得到的产物,即![]() ,
,
故答案为: ;
;![]() ;
;
(5)![]() 该反应转移了10个电子,即转移10个电子生成5个氯气,故转移0.4mol电子时生成氯气0.2mol,标况下体积为4.48L,
该反应转移了10个电子,即转移10个电子生成5个氯气,故转移0.4mol电子时生成氯气0.2mol,标况下体积为4.48L,
答案为: 4.48L。