题目内容
【题目】某班几个兴趣小组做了以下实验。
甲组:两同学利用下列试剂:铁粉、0.1mol/L FeCl3溶液、0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+ 的性质,设计实验方案进行实验,完成下列表格。
探究内容 | 实验方案 | 实验现象 | 写出离子方程式 |
①探究Fe2+具有还原性 | 取少FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量________。 | 溶液先不变红,后变为血红色。 | Fe2+发生的反应: _____________ |
②探究Fe3+具有氧化性 | 取少量FeCl3溶液,加入足 量______后,振荡,静置,再往溶液中加入少量KSCN溶液。 | 溶液不变为血红色。 | Fe3+发生的反应:________ |
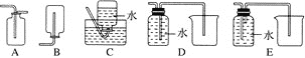
乙组:两同学利用下图所示的装置进行铁与水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
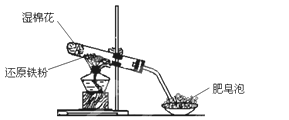
请回答下列问题。
(1)硬质试管中发生反应的化学方程式为_______________。
(2)欲确定反应后硬质试管中固体物质的成分,实验过程如下:
①待硬质试管冷却后,取少许其中的固体物质溶于足量稀硫酸得溶液B;
②取少量溶液B于试管a中,滴加KSCN溶液,溶液没有变红色,则溶液B中的阳离子有_________________,硬质试管中固体物质的成分是_________________。
(3)另取少量溶液B,使其与NaOH溶液反应(按图所示),在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。请写出与上述现象中白色沉淀转化红褐色沉淀的化学方程式________________。
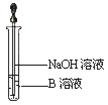
(4)一段时间后,发现a中未变红的溶液变成红色,原因是 _______________
【答案】新制氯水 Cl2 + 2Fe2+ = 2Fe3++ 2 Cl- 铁粉 Fe + 2Fe3+ = 3Fe2+ 3Fe + 4H2O(g) ![]() Fe3O4 + 4H2 H+和Fe2+ Fe ,Fe3O4 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 空气中的氧气将Fe2+氧化为Fe3+
Fe3O4 + 4H2 H+和Fe2+ Fe ,Fe3O4 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 空气中的氧气将Fe2+氧化为Fe3+
【解析】
甲组:探究亚铁离子具有还原性,依据图表中实验步骤,加入硫氰酸钾溶液不变红色,证明无铁离子,加入氧化剂氯水会氧化亚铁离子为铁离子,结合硫氰酸根离子形成血红色溶液分析;探究铁离子具有氧化性依据步骤可知加入过量铁粉和铁离子反应生成亚铁离子,加入硫氰酸钾溶液无红色出现;
乙组:(1)该反应为铁与水蒸气的反应;
(2)滴加KSCN溶液,溶液没有变红色,说明没有Fe3+,据此分析;
(3)氢氧化亚铁容易被空气氧化。
(4)变红说明生成了Fe3+;
甲组:探究亚铁离子具有还原性,依据图表中实验步骤,加入硫氰酸钾溶液不变红色,证明无铁离子,加入氧化剂氯水会氧化亚铁离子为铁离子,结合硫氰酸根离子形成血红色溶液,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;故答案为:新制氯水,2Fe2++Cl2=2Fe3++2Cl-;
探究铁离子具有氧化性依据步骤可知加入过量铁粉和铁离子反应生成亚铁离子,加入硫氰酸钾溶液无红色出现,反应的离子方程式为:2Fe3++Fe=3Fe2+;故答案为:铁粉,2Fe3++Fe=3Fe2+;
乙组:(1)铁与水蒸气反应生成四氧化三铁和氢气,故答案为:![]() ;
;
(2)滴加KSCN溶液,溶液没有变红色,说明没有Fe3+,而铁与水蒸气的反应产物中有四氧化三铁,加足量稀硫酸发生反应:![]() ;此时溶液中一定有Fe3+,价KSCN溶液没有变红,说明三价铁被还原,综合分析还原剂只能是未反应完的铁单质,发生反应:Fe + 2Fe3+=3Fe2+,因为加了足量酸,所以阳离子还有氢离子,故答案为:H+和Fe2+; Fe ,Fe3O4;
;此时溶液中一定有Fe3+,价KSCN溶液没有变红,说明三价铁被还原,综合分析还原剂只能是未反应完的铁单质,发生反应:Fe + 2Fe3+=3Fe2+,因为加了足量酸,所以阳离子还有氢离子,故答案为:H+和Fe2+; Fe ,Fe3O4;
(3)氢氧化亚铁容易被空气中的氧气氧化,故答案为:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;
(4)未变红的溶液变成红色说明Fe2+被氧化成Fe3+,氧化剂为氧气,
故答案为:空气中的氧气将Fe2+氧化为Fe3+;