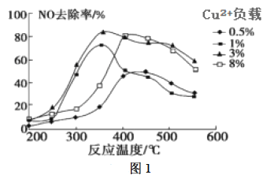
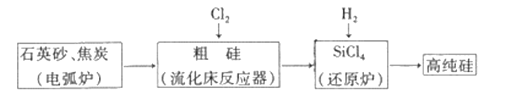
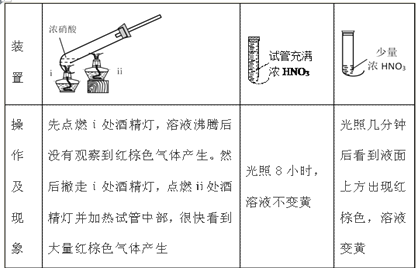
题目内容
【题目】取4.64g铁屑(含有Fe2O3、CuO杂质),加入足量的稀硫酸溶解,产生标准状况下气体V mL,过滤后得到0.64g残渣和滤液M(无Cu2+)。在滤液M中加入足量NaOH溶液过滤残渣充分灼烧得到4.80g固体。请计算:
(1)滤液M中存在的金属阳离子有____。
(2)参与反应的硫酸的物质的量为___mol。
(3)V=____。
【答案】Fe2+ 0.06 448 mL
【解析】
(1)加入足量的稀硫酸溶解,过滤后得到0.64g残渣,且滤液M无Cu2+,由于硫酸足量,Fe、Cu能与Fe3+反应,则残渣为Cu,滤液M中金属阳离子为Fe2+;
(2)滤液M中溶质为FeSO4,加入足量的NaOH,由于氢氧化亚铁易被氧化,过滤充分灼烧得到4.80g固体为Fe2O3,根据Fe原子守恒计算硫酸亚铁的物质的量,再根据硫酸根守恒计算硫酸的物质的量;
(3)纵观整个反应过程,原混合物可以看作FeO、Cu、Fe的混合物,其中FeO、Fe的总质量为4.64g-0.64g=4g,由Fe原子守恒可知FeO、Fe的总物质的量,联立计算各自物质的量,根据电子转移守恒计算氢气的体积。
(1)加入足量的稀硫酸溶解,过滤后得到0.64g残渣,且滤液M无Cu2+,由于硫酸足量,Fe、Cu能与Fe3+反应,则残渣为Cu,滤液M中金属阳离子为Fe2+,故答案为:Fe2+;
(2)滤液M中溶质为FeSO4,加入足量的NaOH,由于氢氧化亚铁易被氧化,过滤充分灼烧得到4.80g固体为Fe2O3,其物质的量为![]() =0.03mol,根据Fe原子守恒,n(FeSO4)=2n(Fe2O3)=0.03mol×2=0.06mol,因此n(H2SO4)=n(FeSO4)=0.06mol,故答案为:0.06;
=0.03mol,根据Fe原子守恒,n(FeSO4)=2n(Fe2O3)=0.03mol×2=0.06mol,因此n(H2SO4)=n(FeSO4)=0.06mol,故答案为:0.06;
(3)纵观整个反应过程,原混合物可以看作FeO、Cu、Fe的混合物,其中FeO、Fe的总质量为4.64g-0.64g=4g,则72g/mol×n(FeO)+56g/mol×n(Fe)=4g,Fe元素最终都转移到4.80g固体为Fe2O3中,由Fe原子守恒可知:n(FeO)+n(Fe)=0.06mol,联立解得:n(FeO)=0.04mol、n(Fe)=0.02mol,根据电子转移守恒可知生成氢气为![]() =0.01mol,则得到氢气体积为0.01mol×22.4L/mol=0.224L,即体积为224mL,故答案为:224 mL。
=0.01mol,则得到氢气体积为0.01mol×22.4L/mol=0.224L,即体积为224mL,故答案为:224 mL。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案