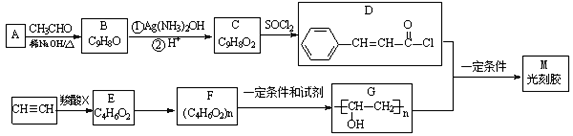
题目内容
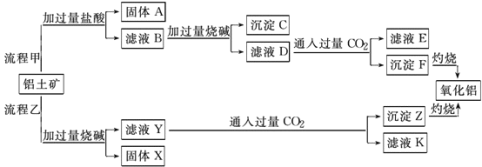
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图:
请回答下列问题:
(1)图中涉及分离溶液和沉淀所采取的操作名称是___,该实验操作用到的玻璃仪器___。
(2)检验滤液B含Fe3+,可取少量滤液并加入__(填试剂名称)。
(3)流程甲通入过量CO2后生成沉淀F的离子反应方程式为__。
(4)流程乙加入烧碱溶解SiO2的化学反应方程式___。
(5)能否将向溶液D中通入过量CO2换成加入过量盐酸?___(填 能 或 不能),其理由是___。
【答案】过滤 烧杯、玻璃棒、漏斗 KSCN AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2NaOH+SiO2=Na2SiO3+H2O 不能 过量盐酸与Al(OH)3反应产生AlCl3(或写为AlO2-+4H+=Al3++2H2O)
【解析】
由工艺流程甲可知,铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质),铝土矿与过量盐酸反应时,Al2O3、Fe2O3、MgO反应变为AlCl3、FeCl3、MgCl2以及过量的HCl,而SiO2不能反应,所以得到的固体A为SiO2,滤液B含有FeCl3、MgCl2、AlCl3、HCl,向滤液B中加入过量的NaOH,FeCl3、MgCl2反应产生Fe(OH)3、Mg(OH)2沉淀;AlCl3变为NaAlO2,HCl反应变为NaCl,因此可推知沉淀C为Fe(OH)3、Mg(OH)2沉淀,滤液D含有NaAlO2、NaCl、NaOH,向滤液D中通入过量CO2,NaAlO2反应生成Al(OH)3沉淀与NaHCO3,沉淀F为Al(OH)3,Al(OH)3分解产生Al2O3和H2O,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中加入过量的NaOH溶液,Al2O3、SiO2能和NaOH反应,生成NaAlO2、Na2SiO3,Fe2O3、MgO不能发生反应,所以固体X为Fe2O3、MgO等,滤液Y为NaAlO2、Na2SiO3、NaOH,向滤液Y中通入过量CO2,NaOH 反应产生NaHCO3,NaAlO2与过量CO2的反应产生Al(OH)3和NaHCO3,Na2SiO3反应产生H2SiO3沉淀,所以沉淀Z为Al(OH)3、H2SiO3,滤液K中含有NaHCO3。
据此分析解答。
根据上述分析可知:沉淀A是SiO2,溶液B中含有FeCl3、MgCl2、AlCl3、HCl,沉淀C为Fe(OH)3、Mg(OH)2,溶液D为NaAlO2、NaCl、NaOH,溶液E为NaCl、NaHCO3,沉淀F为Al(OH)3。固体X为Fe2O3、MgO,溶液Y为NaAlO2、Na2SiO3、NaOH,沉淀Z为Al(OH)3、H2SiO3,滤液K中含有NaHCO3。
(1)图中分离溶液和沉淀所采取的操作名称过滤,所用玻璃仪器有烧杯、玻璃棒、漏斗;
(2)验证滤液B中含Fe3+的方法是:取少量滤液向其中加入KSCN溶液,若溶液变血红色,证明滤液中含Fe3+;
(3)滤液D中含有NaAlO2、NaCl、NaOH,向滤液D中通入过量CO2,NaAlO2与CO2、H2O反应生成Al(OH)3沉淀与NaHCO3,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)流程乙中加入烧碱,NaOH与SiO2反应产生Na2SiO3和H2O,反应的化学反应方程式2NaOH+SiO2=Na2SiO3+H2O;
(5)溶液D中含有NaAlO2、NaCl、NaOH,向D中通入过量CO2气体,由于CO2与H2O反应产生的H2CO3是弱酸,不能与反应产生的Al(OH)3反应,最后会得到Al(OH)3沉淀;HCl是强酸,能够与两性氢氧化物Al(OH)3发生反应,所以若向溶液D中通入过量CO2换成加入过量盐酸,NaAlO2与少量HCl反应产生的Al(OH)3沉淀被过量盐酸溶解反应产生可溶性的AlCl3,所以不能用稀盐酸代替二氧化碳。