题目内容
铜锌原电池(如右图)工作时,下列叙述正确的是
| A.在外电路中,电流从Zn极流向Cu极 |
| B.盐桥中的Cl-移向CuSO4溶液 |
| C.当负极减小65g时,正极增加65g |
| D.电池的总反应为 Zn + Cu2+=Zn2+ + Cu |
D
解析试题分析:A、原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,锌比铜活泼,因此锌是负极,铜是正极,在外电路中,电流从铜极流向锌极,A不正确;B、盐桥中氯离子向负极即向硫酸锌溶液移动,B不正确;C、负极锌减少65g即1mol锌时转移2mol电子,则正极铜离子得到2mol电子生成1mol铜,因此正极增加64g,C不正确;D、电池的总反应为 Zn + Cu2+=Zn2+ + Cu,D正确,答案选D。
考点:考查原电池原理的应用

练习册系列答案
相关题目
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )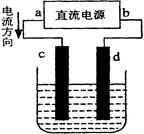
| A.b为正极、a为负极 | B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 | D.电解过程中,氯离子浓度不变 |
下列叙述中正确的是
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 |
| C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀 |
| D.原电池工作时,电解质溶液中的阴离子向负极移动 |
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关该反应的说法正确的是
| A.反应中MnO2是还原剂 |
| B.Ag的还原性比Na2Mn5O10强 |
| C.该反应中MnO2具有催化作用 |
| D.每生成1 mol Na2Mn5O10转移1 mol电子 |
下列关于铜电极的叙述,不正确的是
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼粗铜时,粗铜作阳极 |
| C.在镀件上电镀铜时可用金属铜作阳极 |
| D.电解稀硫酸制H2、O2时,铜作阳极 |
锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是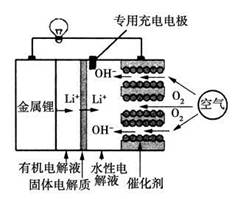
| A.该电池放电时,正极的反应式为O2+4e-+4H+===2H2O |
| B.该电池充电时,阴极发生了氧化反应:Li++e-===Li |
| C.电池中的有机电解液可以用稀盐酸代替 |
| D.正极区产生的LiOH可回收利用 |
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是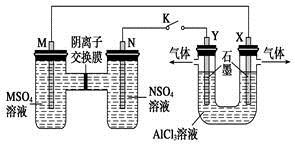
| A.溶液中c(M2+)减小 |
| B.N的电极反应式:N=N2++2e- |
| C.X电极上有H2产生,发生还原反应 |
| D.反应过程中Y电极周围生成白色胶状沉淀 |
按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )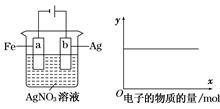
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量
⑤溶液的pH
| A.①③ | B.③④ | C.①②④ | D.①②⑤ |
