题目内容
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关该反应的说法正确的是
| A.反应中MnO2是还原剂 |
| B.Ag的还原性比Na2Mn5O10强 |
| C.该反应中MnO2具有催化作用 |
| D.每生成1 mol Na2Mn5O10转移1 mol电子 |
B
解析试题分析:A、该反应中锰元素的化合价由+4价→+ 价,所以二氧化锰得电子作氧化剂,故A错误;B、该反应中,银是还原剂,Na2Mn5O10是还原产物,所以银的还原性比Na2Mn5O10强,故B正确;C、该反应中,二氧化锰参加反应作氧化剂,故C错误;D、每生成1 molNa2Mn5O10转移(4-
价,所以二氧化锰得电子作氧化剂,故A错误;B、该反应中,银是还原剂,Na2Mn5O10是还原产物,所以银的还原性比Na2Mn5O10强,故B正确;C、该反应中,二氧化锰参加反应作氧化剂,故C错误;D、每生成1 molNa2Mn5O10转移(4- )mol×5="2" mol电子,故D错误;故选B。
)mol×5="2" mol电子,故D错误;故选B。
考点:考查氧化性、还原性强弱的比较;氧化还原反应的电子转移数目计算

练习册系列答案
相关题目
以葡萄糖为燃料的微生物燃料电池结构如右图所示。a为电池的正极,关于该电池的叙述正确的是
| A.该电池能够在高温下工作 | B.b电极发生还原反应 |
| C.O2在a电极被氧化 | D.电流从a电极经用电器流向b电极 |
在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是( )
| A.1.12LH2 | B.1.12LO2 | C.2.24LH2 | D.2.24LO2 |
铜锌原电池(如右图)工作时,下列叙述正确的是
| A.在外电路中,电流从Zn极流向Cu极 |
| B.盐桥中的Cl-移向CuSO4溶液 |
| C.当负极减小65g时,正极增加65g |
| D.电池的总反应为 Zn + Cu2+=Zn2+ + Cu |
如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是
| A.产生气体的体积:(1)> (2) |
| B.电极上析出物质的质量:(1)> (2) |
| C.溶液pH的变化:(1)增大,(2)减小 |
| D.电极反应式:(1)中阳极:4OH--4e-===2H2O+O2↑,(2)中负极:2H++2e-===H2↑ |
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是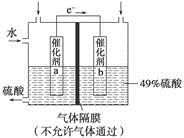
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是SO2+2H2O-2e-===SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 |
下列有关电池的说法不正确的是
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
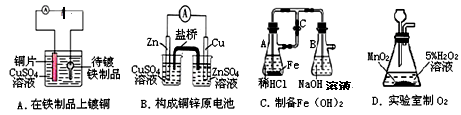
为防止钢铁锈蚀,下列防护方法中正确的是( )
| A.在精密机床的铁床上安装铜螺钉 |
| B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中 |
| C.在海轮舷上用铁丝系住锌板浸在海水里 |
| D.在电动输油管的铸铁管上接直流电源的正极 |