题目内容
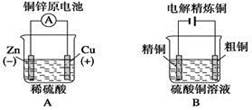
下列叙述中正确的是
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 |
| C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀 |
| D.原电池工作时,电解质溶液中的阴离子向负极移动 |
D
解析试题分析:A.构成原电池正极和负极的材料必须是两种活动性不同的金属或非非金属。错误。B.由铜、锌作电极与硫酸铜溶液组成的原电池中由于Zn活动性比Cu强,所以Zn是负极,铜是正极。错误。C.马口铁(镀锡铁)破损时由于金属活动性Fe>Sn,所以在与电解质溶液接触活动性强的Fe先被腐蚀 。错误。D.原电池工作时,根据同种电荷相互排斥,异种电荷相互吸引,所以电解质溶液中的阴离子向正电荷较多的负极移动。正确。
考点:考查原电池的形成条件及工作原理的知识。

练习册系列答案
相关题目
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池。如图,下列有关分析正确的是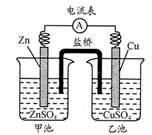
| A.负极发生氧化反应:Cu—2e—=Cu2+ |
| B.电池工作时,盐桥逐渐变蓝 |
| C.向乙池中通入H2S后,电池反应停止 |
| D.若将电极Cu改为石墨,电池电流强度发生变化 |
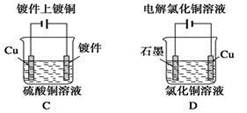
下列叙述中正确的是
| A.图①中正极附近溶液pH降低 |
| B.图①中电子由Zn流向Cu,盐桥中的Cl—移向CuSO4溶液 |
C.图②正极反应是O2+2H2O+4e¯ 4OH¯ 4OH¯ |
| D.图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
以葡萄糖为燃料的微生物燃料电池结构如右图所示。a为电池的正极,关于该电池的叙述正确的是
| A.该电池能够在高温下工作 | B.b电极发生还原反应 |
| C.O2在a电极被氧化 | D.电流从a电极经用电器流向b电极 |
下列关于铜电极的叙述不正确的是
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼铜时粗铜作阳极 |
| C.在镀件上镀铜时可用铜作阳极 |
| D.电解稀H2SO4制H2、O2时铜做阳极 |
铜锌原电池(如右图)工作时,下列叙述正确的是
| A.在外电路中,电流从Zn极流向Cu极 |
| B.盐桥中的Cl-移向CuSO4溶液 |
| C.当负极减小65g时,正极增加65g |
| D.电池的总反应为 Zn + Cu2+=Zn2+ + Cu |
关于下列各装置图的叙述中,正确的是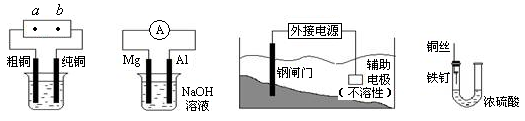
① ② ③ ④
| A.用装置①精炼铜,则a极为电源正极,电解质溶液为CuSO4溶液 |
| B.装置②中Mg为负极 |
| C.装置③中钢闸门应与外接电源的正极相连 |
| D.装置④中的铁钉被腐蚀 |
如下图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )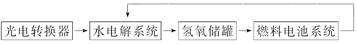
向日面时 背日面时
| A.该能量转化系统工作时,需不断补充H2O |
| B.该转化系统的能量本质上来源于太阳能 |
| C.水电解系统中的阴极反应:O2+2H2O+4e-=4OH- |
| D.燃料电池放电时的负极反应:H2-2e-=2H+ |