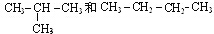题目内容
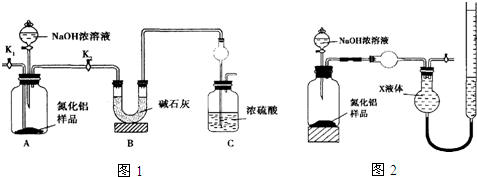
3.试写出工业上海水提溴、实验室中海带提碘过程中所发生的主要反应的离子方程式.根据上述事实,关于Cl2、Br2、I2、H202、SO2五种物质的氧化性相对强弱,你可以明确得出的结论有哪些?推测下列过程的结果,写出有关反应的化学方程式.(1)将氯气通入溴化钠溶液中;
(2)将氯气通入氟化钠溶液中;
(3)将氯气通入碘化钠溶液中;
(4)将碘加入溴化钠溶液中.
分析 工业上用空气吹出法从海水中提取溴涉及的离子反应有:①Cl2+2I-=I2+2Cl-、②SO2+Br2+H2O═4H++SO42-+2Br-;
实验室中海带提碘过程中所发生的离子反应为:2I-+2H++H2O2═I2+2H2O,
根据以上反应可知氧化性:Cl2>Br2>SO2、H202>I2,
(1)由于氧化性:Cl2>Br2,则二者发生反应生成氯化钠和溴;
(2)由于氯气的氧化性小于氟气,则氯气不与氟化钠反应;
(3)由于氧化性:Cl2>I2,则氯气与碘化钠发生反应生成氯化钠和碘;
(4)由于氧化性:Br2>I2,则碘单质不与溴化钠反应.
解答 解:工业上用空气吹出法从海水中提取溴涉及的离子反应为:①Cl2+2I-=I2+2Cl-、②SO2+Br2+H2O═4H++SO42-+2Br-;实验室中海带提碘过程中所发生的离子反应为:2I-+2H++H2O2═I2+2H2O,根据上面的反应可知氧化性:Cl2>Br2>SO2、H202>I2,
(1)将氯气通入溴化钠溶液中,由于氧化性:Cl2>Br2,则二者发生反应生成氯化钠和溴,反应的化学方程式为:Cl2+2NaBr=2NaCl+Br2,
故答案为:发生反应:Cl2+2NaBr=2NaCl+Br2;
(2)将氯气通入氟化钠溶液中,由于氯气的氧化性小于氟气,则二者不发生反应,
故答案为:不反应;
(3)将氯气通入碘化钠溶液中,由于氧化性:Cl2>I2,则二者发生反应生成氯化钠和碘,反应的化学方程式为:Cl2+2NaI=2aCl+I2,
故答案为:发生反应:Cl2+2NaI=2aCl+I2;
(4)将碘加入溴化钠溶液中,由于氧化性:Br2>I2,则二者不发生反应,
故答案为:不反应.
点评 本题考查了离子方程式的书写、氧化还原反应中氧化性、还原性强弱判断及其应用,题目难度中等,明确发生反应原理为解答关键,注意掌握氧化还原反应中氧化性、还原性强弱的判断方法,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铁片表面出现气泡 | |
| B. | 用锌片做阳极铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 | |
| D. | 把少量锌粒放入盛有足量的盐酸试管中,加几滴氯化铜溶液,气泡放出速率加快,生成氢气的总量不变 |
| A. | 标准状况下,11.2 L的戊烷所含的分子0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA |
| A. | v(Fe)=0.5 mol•L-1•min-1 | B. | v(H2SO4)=1 mol•L-1•min-1 | ||
| C. | v(H2)=0.25 mol•L-1•min-1 | D. | v(FeSO4)=0.25 mol•L-1•min-1 |
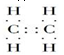 ,B的结构简式
,B的结构简式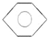 或
或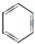 .
. ,
,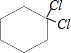 、
、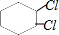 、
、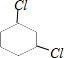 、
、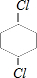 .
.
 NH4+
NH4+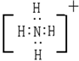
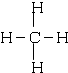 ; CO2O=C=O
; CO2O=C=O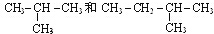 I.
I.