题目内容
13.下列关于实验现象的描述正确的是( )| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铁片表面出现气泡 | |
| B. | 用锌片做阳极铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 | |
| D. | 把少量锌粒放入盛有足量的盐酸试管中,加几滴氯化铜溶液,气泡放出速率加快,生成氢气的总量不变 |
分析 A.铜片和铁片和稀硫酸构成原电池,铜作负极;
B.阳极是活性金属锌,所以阳极金属锌失去电子发生氧化反应,阴极上溶液中的阳离子即锌离子得到电子变成锌,在铁极上析出;
C.铜的金属活动性不及铁,不能置换金属铁;
D.构成原电池反应,可以加速反应的速率,金属锌的量少量,根据金属锌的质量来计算氢气的量.
解答 解:A.把铜片和铁片紧靠在一起浸入稀硫酸中,形成铜、铁、稀硫酸原电池,正极是金属铜,该极上电子和溶液中的氢离子结合产生氢气,故A错误;
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,这是一个电镀池,镀层金属锌作阳极,待镀件铁作阴极,镀层金属盐氯化锌溶液作电解质,发生反应:阳极:Zn-2e-=Zn2+;阴极:Zn2++2e-=Zn,故B正确;
C.把铜片插入三氯化铁溶液中,铜和氯化铁反应生成氯化铜和氯化亚铁,铜的金属活动性不及铁,铜不能置换出铁,故C错误;
D.把少量锌粒放入盛有足量的盐酸试管中,加入几滴氯化铜溶液,锌置换出铜,所以形成了铜、锌、稀盐酸原电池,原电池反应可以加速反应的速率,但是金属锌的消耗使得生成氢气的物质的量减少,故D错误;
故选B.
点评 本题主要考查了原电池的有关应用,解答须理解原电池的构成条件反应原理,题目较简单.

练习册系列答案
相关题目
3.化学实验操作准确性非常重要,如图分别表示四种操作,其中有两处错误的是( )
| A. |  读数 | B. |  稀释 | C. |  称量 | D. |  溶解 |
4.某元素X的原子的核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关X的说法中不正确的是( )
| A. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| B. | X能与某些金属元素形成化合物 | |
| C. | X能形成化学式为X(OH)3的碱 | |
| D. | X可能形成化学式为KXO3的盐 |
1.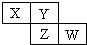 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的非金属性比Y的强 | |
| B. | Y的原子半径比Z的原子半径大 | |
| C. | Z的最高价氧化物的水化物为强酸 | |
| D. | W的单质可与Y的氢化物生成两种强酸 |
18.下列关于硫酸性质的描述中,正确的是( )
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 稀H2SO4与铜不反应,但浓H2SO4在加热条件下可与铜反应 | |
| D. | 在受热的情况下浓硫酸也不与铁、铝发生反应 |
5.下列性质中,可以证明某化合物形成的晶体一定是离子晶体的是( )
| A. | 可溶于水 | B. | 具有较高的熔点 | C. | 水溶液能导电 | D. | 熔融状态能导电 |
2.等质量的下列烃完全燃烧,消耗O2最多的是( )
| A. | C2H6 | B. | CH4 | C. | C2H4 | D. | C5H12 |
