题目内容
7.依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示: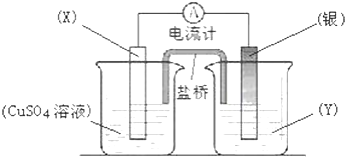
请回答下列问题:
(1)电极X的材料是Cu;电解质溶液Y是AgNO3;
(2)银电极的电极反应式为Ag++e-=Ag
(3)盐桥中有饱和NH4NO3溶液,其中铵根离子的移动方向为a
a.向银电极 b.向X电极 c.不移动 d.无法确定移动方向
(4)该电池工作一段时间后测得X电极的质量减少1.92g,则在外电路中通过的电子数为0.06NA.
分析 根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极,由此分析解答.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,
故答案为:Ag++e-=Ag;
(3)盐桥中装有含饱和NH4NO3溶液,则盐桥中 铵根离子移向正极,也就是右侧烧杯中的银电极,故答案为:a;
(4)据Cu电极的,电极反应为Cu-2e-=Cu2+可知,每反应1molCu,转移2mol电子,电极的质量减少1.92g时在外电路中通过的电子数为$\frac{1.92g}{64g/mol}$×2×NA=0.06NA,
故答案为:0.06NA.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.

练习册系列答案
相关题目
18.已知2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.下列关于该反应的说法中正确的是( )
①该反应是一个放热反应
②参加反应的氢气和氧气的总能量高于反应生成的水的总能量
③该反应是一个吸热反应
④参加反应的氢气和氧气的总能量低于反应生成的水的总能量.
①该反应是一个放热反应
②参加反应的氢气和氧气的总能量高于反应生成的水的总能量
③该反应是一个吸热反应
④参加反应的氢气和氧气的总能量低于反应生成的水的总能量.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
15.三种主族非金属元素X、Y、Z在周期表中的位置如图所示,则下列说法中错误的是( )
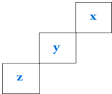

| A. | 元素Z一定是长周期元素,且既有金属性又有非金属性 | |
| B. | 三种元素中X元素的最高价氧化物对应的水化物酸性最强 | |
| C. | 三种元素中X元素的气态氢化物还原性最弱 | |
| D. | Y元素可形成多种不同的单质 |
2.相同条件下,下列各组中的两个反应的焓变前者大于后者的是( )
| A. | H2(g)+Cl2(g)=2HCl(g) 和H2(g)+Cl2(g)=2HCl(aq) | |
| B. | C2H4(g)+H2(g)=C2H6(g)和C3H6(g)+H2(g)=C3H8(g) | |
| C. | 2H2(g)+O2(g)=2H2O(l)和2H2(g)+O2(g)=2H2O(g) | |
| D. | C(s)+O2(g)=CO2(g)和C(s)+$\frac{1}{2}$O2(g)=CO(g) |
12.镁粉是制造烟花的重要原料之一,生产镁粉时,将镁蒸气在某种气体中冷却,下列气可作为冷却气的是( )
| A. | 空气 | B. | 氮气 | C. | 氩气 | D. | 二氧化碳 |
19.如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )


| A. | 1个乙分子中含有2个A原子 | B. | 摩尔质量关系为:2M (甲)=M (乙)+M (丙) | ||
| C. | 该反应一定属于氧化还原反应 | D. | 该反应类型是分解反应 |
16.下列各组物质发生状态变化时,所克服的微粒间的相互作用,属于同种类型的是( )
| A. | 氧化钠和硫的熔化 | B. | 食盐和石蜡的熔化 | ||
| C. | 碘和干冰的升华 | D. | 氯化铵的分解和氯化钠溶解于水 |
17.用一定体积、一定浓度的盐酸跟过量的锌反应制取一定体积的氢气,为了提高化学反应速率而又不影响生成氢气的体积,下列措施中合理的是( )
| A. | 加少量稀硫酸 | B. | 加热 | C. | 加蒸馏水 | D. | 加少量蓝矾 |