题目内容
14.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液态烃,0.1mol该烃在足量的氧气中完全燃烧,生成0.6molCO2和0.3mol水;回答下列问题:(1)A的电子式
 ,B的结构简式
,B的结构简式 或
或 .
.(2)A和B中,能使溴的四氯化碳溶液褪色的化学反应方程式:CH2=CHCH3+Br2→CH2BrCHBrCH3,反应类型:加成反应.
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:
 ,
,(4)等质量的A、B完全燃烧时消耗O2的物质的量A>B(填“A>B”、“A<B”或“A=B”).
(5)B与H2加成反应的产物的二氯代物的结构简式:
 、
、 、
、 、
、 .
.
分析 (1)A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B是一种比水轻的油状液态烃,0.1mol该烃在足量的氧气中完全燃烧,生成0.6mol CO2和0.3mol水,该烃中N(C)=$\frac{0.6mol}{0.1mol}$=6、N(H)=$\frac{0.3mol×2}{0.1mol}$=6,故B的分子式为C6H6,B的相对分子质量为78,则12n+2n-6=78,解得n=6,所以B为苯,
(2)中与A相邻的同系物C使溴的四氯化碳溶液褪色,则C为CH2=CH-CH3;
(3)苯与浓硝酸在浓硫酸、加热条件下发生硝化反应生成硝基苯;
(4)等质量的烃完全燃烧,烃中H元素质量分数越大,消耗氧气越多;
(5)苯与氢气发生加成反应生成环己烷,环己烷的二氯代物分为:两个Cl同碳及处于环的邻、间、对碳四种结构.
解答 解:(1)A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B是一种比水轻的油状液态烃,0.1mol该烃在足量的氧气中完全燃烧,生成0.6mol CO2和0.3mol水,该烃中N(C)=$\frac{0.6mol}{0.1mol}$=6、N(H)=$\frac{0.3mol×2}{0.1mol}$=6,故B的分子式为C6H6,B的相对分子质量为78,则12n+2n-6=78,解得n=6,所以B为苯,则:A的电子式为 ,B的结构简式为:
,B的结构简式为: 或
或  ,
,
故答案为: ;
; 或
或  ;
;
(2)A相邻的同系物C为CH2=CHCH3,使溴水褪色发生加成反应,该反应为:CH2=CHCH3+Br2→CH2BrCHBrCH3,
故答案为:CH2=CHCH3+Br2→CH2BrCHBrCH3;加成反应;
(3)B与浓H2SO4与浓HNO3在50-60℃反应生成硝基苯,反应的化学反应方程为: ,
,
故答案为: ;
;
(4)乙烯中H元素质量分数比苯中H元素质量分数大,故相同质量的乙烯、苯燃烧,乙烯消耗的氧气更多,即等质量的A、B完全燃烧时消耗O2的物质的量A>B,
故答案为:A>B;
(5)苯与氢气加成生成环己烷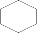 ,环己烷的二氯代物有:
,环己烷的二氯代物有: 、
、 、
、 、
、 ,
,
故答案为: 、
、 、
、 、
、 .
.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,侧重对基础知识的考查,注意熟练掌握常见有机物结构与性质,明确等质量的烃中H的质量分数越大,完全燃烧消耗氧气越大.

 名校课堂系列答案
名校课堂系列答案| A. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| B. | X能与某些金属元素形成化合物 | |
| C. | X能形成化学式为X(OH)3的碱 | |
| D. | X可能形成化学式为KXO3的盐 |
| A. | 可溶于水 | B. | 具有较高的熔点 | C. | 水溶液能导电 | D. | 熔融状态能导电 |
| A. | C2H6 | B. | CH4 | C. | C2H4 | D. | C5H12 |
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键
②单位时间内生成n molI2的同时生成2n molHI
③2v正(H2)=v逆(HI)
④HI分子数不再改变
⑤混合气体颜色不再改变
⑥混合气体压强不再改变.
| A. | ②④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | 全部 |
| A. | 0.1mol | B. | 0.4mol | C. | 1.1mol | D. | 1.6mol |
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极 | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |