题目内容
15.取某铁的氧化物样品,用140mL 5mol/L盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中的Fe2+ 完全转化为 Fe3+,该样品中可能的化学式是( )| A. | Fe3O4 | B. | Fe4O5 | C. | Fe5O6 | D. | Fe5O7 |
分析 n(HCl)=0.14L×0.5mol/L=0.07mol,n(Cl2)=$\frac{0.56L}{22.4L/mol}$=0.0025mol,反应中HCl的H元素与氧化物中O元素全部结合生成H2O,反应后溶液成分为FeCl3,结合质量守恒计算.
解答 解:n(HCl)=0.14L×5mol/L=0.7mol,n(Cl2)=$\frac{0.56L}{22.4L/mol}$=0.0025mol,反应中HCl的H元素与氧化物中O元素全部结合生成H2O,则氧化物中n(O)=$\frac{1}{2}$×n(HCl)=$\frac{1}{2}$×0.07mol=0.035mol,反应后溶液成分为FeCl3,n(Cl-)=0.07mol+0.0025mol×2=0.075mol,则n(Fe)=0.075mol×$\frac{1}{3}$=0.025mol,所以:n(Fe):n(O)=0.025mol:0.035mol=5:7,该氧化物的化学式为Fe5O7,
故选D.
点评 本题考查氧化还原反应的计算,题目难度中等,注意反应中HCl的H元素与氧化物中O元素全部结合生成H2O,反应后溶液成分为FeCl3,为解答该题的关键,做题时注意体会.

练习册系列答案
相关题目
6.如图曲线图(纵坐标为沉淀的量,横坐标为加入物的量)不正确的是( )
| A. |  向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 | |
| B. |  向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 | |
| C. |  向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] 向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] | |
| D. |  向AlCl3溶液滴加过量氨水 向AlCl3溶液滴加过量氨水 |
10.能正确表示下列反应的离子方程式为( )
| A. | 向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++NO3-═Fe3++NO2↑+H2O | |
| B. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O═Mg(OH)2↓+2Na+ | |
| D. | 向0.1mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
4.由一个O,一个N,7个H和若干个碳原子组成的有机物,其碳原子的个数至少为( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
5.a g CO 和H2的混合气体在足量O2中完全燃烧后,将产生的CO2和水蒸气通入过量的过氧化钠被其完全吸收,问过氧化钠固体质量增加多少g.( )
| A. | a g | B. | 0.5a g | C. | 4.4a g | D. | 1.8a g |
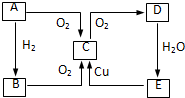 在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答:
在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答: ,共价键
,共价键