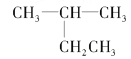
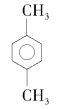
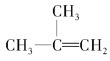
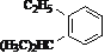题目内容
【题目】某兴趣小组利用废旧电池的铜帽(铜锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:
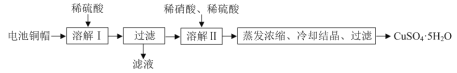
(1)“溶解Ⅱ”过程中,发生反应的离子方程式为___。
(2)“溶解Ⅱ”过程中应控制反应温度,温度不能过高的原因是___。
(3)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.540g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00 mL。实验过程中发生的反应如下:2Cu2++4I-=2CuI↓+I2、2S2O32-+I2=S4O62-+2I-
①配制250mL溶液所需的玻璃仪器除烧杯、胶头滴管外还有___。
②计算出样品中CuSO4·5H2O的质量分数。___(写出计算过程)
【答案】3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 防止硝酸挥发及分解 250mL容量瓶、玻璃棒 98.43%
【解析】
废弃旧电池的铜帽用稀硫酸其中的Zn,经过滤后得到不溶于酸的Cu,再用稀硫酸和稀硝酸溶解Cu,因硝酸具有强氧化性,能在酸性条件下氧化铜生成铜盐,将所得硫酸铜溶液加热蒸发浓缩,再冷却结晶,最后过滤、洗涤即可获得CuSO4·5H2O;
(1)“溶解Ⅱ”过程中是Cu溶解于稀硝酸生成硝酸铜、NO和水;
(2)硝酸具有挥发性,且不稳定;
(3)①根据配制一定物质的量浓度的溶液操作步骤判断需要的玻璃仪器;
②已知:2Cu2++4I-═2CuI(白色)↓+I2,2S2O32-+I2═2I-+S4O62-,得关系式2CuSO4·5H2O~2Cu2+~I2~2S2O32-,结合滴定时消耗的Na2S2O3溶液体积,计算参加反应的Na2S2O3的物质的量,再计算出CuSO4·5H2O的物质的量,最后计算样品的质量分数。
(1)“溶解Ⅱ”过程中是Cu溶解于稀硝酸生成硝酸铜、NO和水,发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)硝酸具有挥发性,且不稳定,受热易分解,故“溶解Ⅱ”过程中应控制反应温度,温度不能过高,以防止硝酸分解和挥发,提高硝酸的利用率,
故答案为:防止硝酸挥发及分解;
(3)①配制250mL溶液的主要操作步骤是称量、溶解、转移、洗涤、定容及摇匀,所需玻璃仪器依次是烧杯、玻璃棒、250mL容量瓶、胶头滴管等,则还需要玻璃棒、250mL容量瓶,
故答案为:250mL容量瓶、玻璃棒;
②n(Na2S2O3)=0.02500L×0.04000mol·L1=1.000×103mol,
根据关系式2Cu2+~I2~2S2O32-,
n(CuSO4)=n(Na2S2O3)=1.000×103mol,
250mL溶液中n(CuSO4)=![]() ×1.000×103mol=1.000×102mol,
×1.000×103mol=1.000×102mol,
m(CuSO4·5H2O)=1.000×102mol×250g·mol1=2.500g,
样品中CuSO4·5H2O的质量分数为![]() ×100%=98.43%。
×100%=98.43%。