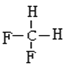
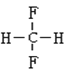
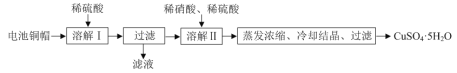
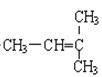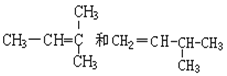题目内容
【题目】A是石油裂解气的主要成分之一,以A为原料制备药物中间体X的合成路线如下:
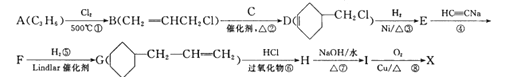
已知i.
ii.![]() 。
。
回答下列同题:
(1)A的结构简式为_________,B的名称为__________,D中含有的官能团的名称是___________。
(2)有机物I的结构简式为___________;反应④的反应类型是___________。
(3)由A生成B的化学方程式为______________________________________。
(4)反应⑧的化学方程式为___________________________________________。
(5)满足以下条件的X的同分异构体有___________种。
i.能发生银镜反应;
ii.含有六元环结构;
iii.六元环上有2个取代基。
其中核磁共振氢谱中有6组峰,且峰面积之比为4:4:3:2:2:1的有机物的结构简式为________(任写一种)。
(6)参照F的合成路线,以CH3CH=CHCH3为原料设计制备 的合成路线:__________(其他试剂任选)。
的合成路线:__________(其他试剂任选)。
【答案】CH3CH=CH2 3—氯—1—丙烯(或3—氯丙烯) 碳碳双键、氯原子 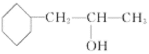 取代反应 CH3CH=CH2+Cl2
取代反应 CH3CH=CH2+Cl2![]() CH2=CHCH2Cl+HCl
CH2=CHCH2Cl+HCl 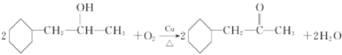 8
8 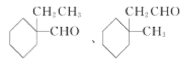
![]()
【解析】
根据A的分子式C3H6分析,该物质为丙烯,和氯气发生取代反应生成B,B和C反应生成D,则C为1,3-丁二烯,D和氢气发生加成反应生成E,E为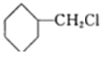 ,G含有碳碳双键,和氯化氢发生加成生成H
,G含有碳碳双键,和氯化氢发生加成生成H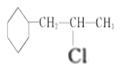 ,在与氢氧化钠水溶液发生取代反应生成醇I
,在与氢氧化钠水溶液发生取代反应生成醇I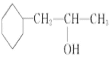 ,再被氧气氧化生成羰基。
,再被氧气氧化生成羰基。
(1)A为丙烯,结构简式为: CH3CH=CH2,B的结构简式为CH2ClCH=CH2,名称为3—氯—1—丙烯(或3—氯丙烯),D含有碳碳双键和氯原子;
(2)化合物I的结构简式为: ![]() ,反应④为E
,反应④为E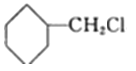 和HC≡CNa发生的取代反应;
和HC≡CNa发生的取代反应;
(3) 由A生成B的化学方程式为丙烯和氯气发生的取代反应,方程式为:
CH3CH=CH2+Cl2![]() CH2=CHCH2Cl+HCl;
CH2=CHCH2Cl+HCl;
(4)反应⑧为羟基的催化氧化反应,方程式为:
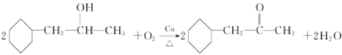 ;
;
(5)X的同分异构体满足以下条件i.能发生银镜反应,说明含有醛基;ii.含有六元环结构;iii.六元环上有2个取代基,六元环上可以连接一个醛基和一个乙基,可以在一个碳原子上,或有邻间对三种位置关系, 也可以是甲基和-CH2CHO,可以在一个碳原子上或有邻间对三种位置关系,共8种。其中核磁共振氢谱中有6组峰,且峰面积之比为4:4:3:2:2:1,说明一个醛基,和一个甲基,结构有对称性,即两个取代基在一个碳原子,结构简式为:
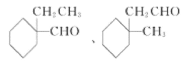 ;
;
(6) 以CH3CH=CHCH3为原料设计制备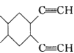 的合成路线,参考F的合成路线分析,说明发生烯烃间的加成反应形成环,再利用环内的双键和卤素发生加成反应,再与HC≡CNa发生取代反应增加碳链,合成路线为:
的合成路线,参考F的合成路线分析,说明发生烯烃间的加成反应形成环,再利用环内的双键和卤素发生加成反应,再与HC≡CNa发生取代反应增加碳链,合成路线为:
![]() 。
。

 阅读快车系列答案
阅读快车系列答案